Tanto la industria cervecera como una facultad de nutrición animal de Argentina nos solicitaron un estudio cuyo objetivo era obtener un producto de alto valor biológico. Para ello se realizó un trabajo sobre la lisis de la levadura de la cerveza y la composición de la pared celular obtenida, verificando las propiedades nutricionales útiles para los animales. ¿Sería posible incluso extender este concepto a la nutrición humana?
Se trataba de extraer y concentrar los glucanos y mananos de la pared celular del Saccharomyces cerevisiae, analizando y cuantificando sus biopolímeros.
Introducción
En Argentina existen tres grandes fuentes de producción de levaduras: la industria alcoholera, la vitivinícola y, la más importante, la cervecera, que produce aproximadamente 1500 toneladas de levadura seca al año. (Una porción se usa durante 6 ciclos productivos consecutivos y la parte no utilizada se trata para la alimentación animal.)
El valor nutritivo de la levadura varía según sea el género de la misma y, en menor medida, por el sustrato utilizado en su crecimiento. En general, no hay bibliografía disponible acerca de la composición química de la levadura industrial usada en los reciclajes cerveceros argentinos. Se puede afirmar 1-3 que la composición de la misma es básicamente:
-
- Proteínas (N x 6,25) (45-50 % s/s).
- Aminoácidos esenciales y no esenciales en proporciones similares.
- Vitaminas del grupo B: ácido nicotínico, B1, ácido pantoténico, B2, B6 y ácido fólico.
- Fibra dietaria total ( 22 % s/s).
- Minerales (6 % s/s).
- Materia grasa (3 % s/s).
- Azúcares totales (0,5 % s/s).
- No contiene factor antinutriente alguno.
La levadura posee un citoplasma y una pared celular que representa del 15-30 % del peso seco de la misma. Está compuesta primariamente por 2 capas:4-12
Capa externa. Está formada por un complejo de manoproteínas (aproximadamente 25-50 %) que corresponde a una asociación de polisacáridos de α-D-manosa con proteínas (manano-oligosacáridos, MOS). Éstas se unen a través de extremos no reductores en forma directa con los 1-3 β-glucanos o, indirectamente, con los 1-6 β-glucanos. Los MOS contienen abundantes polipéptidos glucosados (50-95 %) que salen como fimbrias afuera de la pared celular, que tienen la capacidad de aglutinar las micotoxinas presentes en el tracto intestinal animal. Así pues, se las puede utilizar como sustituto de coccidiostáticos y/o antibióticos usados como promotores de crecimiento en las aves y otros animales, ya que se ha descubierto que su acción central consiste en el bloqueo competitivo de las lectinas bacterianas debido a que las fimbrias tipo 1 de la superficie de las bacterias patógenas reconocen específicamente las glucoproteínas de la pared celular y las aglutinan. En general, no se dispone de información del contenido de MOS presente en la pared de la levadura de cerveza usada en Argentina.
Capa interna. Está constituida por un complejo de glucomananos (aproximadamente 25-30 %) que son β-glucanos asociados a una pequeña cantidad de quitina. Dicho complejo lo forman:
-
- 1-3 β-glucanos: moléculas helicoidales de aproximadamente 1500 glucosas, que representan el 30-35 % de la masa celular. Su función es mantener la estructura mecánica de la pared celular.
- 1-6 β-glucanos: moléculas lineales de aproximadamente 150 glucosas, que representan el 10 % de la masa celular. Dicha masa está muy ramificada, y es la fracción responsable de organizar la pared celular, ya que se interconecta simultáneamente con los glucanos y manoproteínas de la capa externa (básicamente glucomananos) y quitina.
Las cadenas de quitina se unen por los extremos no reductores a las cadenas de β-glucanos 1-3 y 1-6 formando una pared celular insoluble. La estructura cristalina de la α-quitina es similar a la α-celulosa.
Los glucomananos presentes en la pared celular de las levaduras son activos funcionalmente. Sus propiedades radican en la «modificación de la respuesta biológica del huésped», pues la transforman mediante la estimulación de los mecanismos de defensa del sistema inmune, frenando todo cambio producido por una agresión bacteriana, viral, fungal, 13-16
Materiales y métodos
La levadura de cerveza se obtuvo de la producción de bioetanol a partir de varias matrices amiláceas (maíz, arroz partido, sorgo, mandioca y patatas) y sacaríferas (melaza).
Se realizaron básicamente tres autolisis de la levadura con el fin de obtener la mejor pared celular posible para determinar los glucanos y mananos.
Se partió de 12 litros de crema de levadura a 4 ºC, que contenían 50 % de sólidos, y se la dejó decantar para su posterior filtrado. Los sólidos obtenidos se lavaron dos veces, con igual volumen de agua, por decantación y se filtraron mediante papel. Se obtuvo cerca de 5 kg de masa de levadura húmeda.
Las tres autolisis fueron:
-
- Hidrólisis con una solución salina hipertónica: sal al 4 % sobre la masa de levadura (2 kg).
- Hidrólisis con solución diluida de hidróxido de sodio 0,1 N: 2 kg de masa de levadura son tratadas con la base hasta alcanzar el pH de 9,25.
- Hidrólisis con la enzima proteasa (1 kg): es de resaltar que en este caso, microscópicamente, se detectó una rotura y apertura muy grande de la pared celular con liberación de aminoácidos azufrados, que presentaron olores desagradables, lo que nos llevó a descartar esta lisis.
En los dos primeros casos se mantuvieron los hidrolizados a 45 ºC durante 24 horas. Mientras la primera originaba abundante espuma, la segunda no. Ambas soluciones fueron llevadas a 4 ºC, y se las dejó en reposo para su posterior decantación, luego se eliminó el protoplasma o extracto soluble. Se confirmó, por tinción y microscopia, que las células ahora obtenidas mantenían su morfología ovoide pero estaban vacías («células fantasmas»). Es importante señalar que es preciso trabajar con centrífuga para así mejorar la separación de la pared celular.
Las paredes celulares fueron lavadas dos veces con igual volumen de agua, obteniendo las fracciones llamadas primero y segundo lavado. Se analizó en ambos casos el contenido de los azúcares glucosa y manosa, al igual que la materia seca, proteínas y materia orgánica, halladas por métodos estándares.
Para la determinación de glucosa y manosa16 se partió de aproximadamente 100 mg de pared celular seca a la que se le agregó, mediante agitación, 3,3 mL de H2SO4 al 72 %. Se dejó una hora a temperatura ambiente agitando cada 10 minutos. Se colocó el contenido en un recipiente de 100 mL al que se le agregaron 40 mL de agua. Todo ello se llevó a 128 ºC en estufa, y se dejó incubar durante tres horas. Una vez enfriado, se neutralizó con 8,1 mL de NaOH al 32 % y finalmente se enrasó. Después de filtrarse se inyectó al equipo de electroforesis capilar de zona.
El equipo de electroforesis utilizado fue HP 1600 AX , que produjo la migración diferencial de glucosa y manosa. La solución fue introducida a una presión de 50 mbares al capilar desnudo de 50 mm de diámetro interno y 80 cm de largo, con 25 kV de polaridad negativa. La detección usada es UV-indirecta por DAD a 350 nm fijando la referencia en 270 nm. Se trabajó a un pH de 12,3 mediante buffer formado por 1,6 mL del colorante piridincarboxílico, PDC, 0,25 mL de bromuro de cetiltrimetilamonio, 0,65 mL de agua y dos gotas de NaOH 1 N.
Cuando se aplicó la polaridad negativa, los azúcares migraron al cátodo.
Resultados
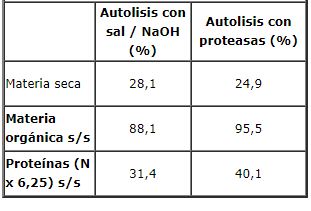
La tabla 1 muestra que la autolisis con sal e hidróxido de sodio dan resultados similares. De todos modos, se continuaron los estudios sobre la hidrólisis con sal ya que es menos agresiva.
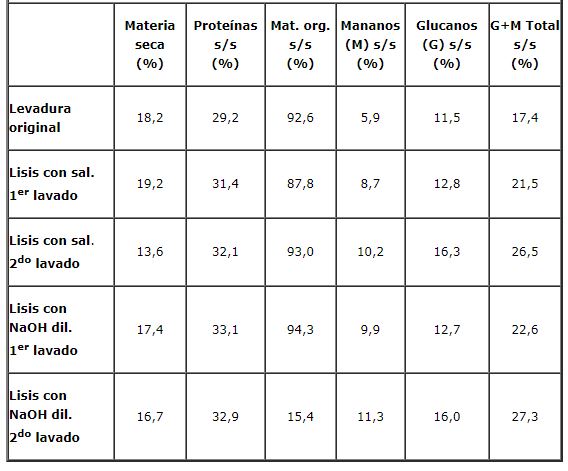
La tabla 2 muestra cómo se incrementan los valores de los constituyentes de la pared celular entre el primero y el segundo lavado. Ello implica que el citoplasma residual va disminuyendo. La transformación de glucosa/manosa en glucanos/mananos respectivamente fue del 0,9.
Conclusiones
La autonomización cultural del vino empieza por esconder su sustrato natural y las etapas más concretas de su elaboración.
Es fundamental poder incrementar el valor agregado de la levadura industrial y, específicamente, del subproducto pared celular, ya que tanto la industria cervecera como la alcoholera incrementan día a día la producción de cervezas y de bioetanol.
Es la primera vez que se realiza en Argentina una determinación de los glucanos y mananos presentes en la pared celular mediante una técnica altamente específica y de una gran sensibilidad.
Bibliografía
- Perdomo M.; Vargas R. «Valor nutritivo de la levadura de cervecería y de sus derivados en la alimentación aviar». Arch Latinoam Prod Anim 2004; 12: 89-95.
- Lyons T.; Jacques K. «Nutritional biotechnology in the feed and food industries» Proceed of Alltech’s 20th Annual Symposium 2005; págs. 475-484 y 283-296.
- Caballero J. «Encyclopedia of Food Science and Nutrition». Amsterdam: Elsevier, 2005.
- Cai Y. (2003) «Optimum of yeast extract processing technology». Food and Machinery 2003; 3: 16-18.
- Breddam K.; Beenfeldt T. «Aceleration of yeast autolysis by chemical methods for production of intracellular enzymes». Appl Microbiol and Biotechnol 1991; 35: 323-329.
- Monch S.; Stute R. «Process for producing yeast extract» U.S. Patent 0081357A1, 2002.
- Koutinas A.; Wang R. «Development of a process for the production of nutrient supplements for fermentations based on fungal autolysis». Enzyme and Microbial Technol 2005; 36: 629-638.
- U.S. Patent 2005/0100881A1, «Method for dissociation of cells».
- Van Gaver D. Huyghebaert A. «Optimization of yeast cell disruption with a newly designed bead mill». Enzyme and Microbial Technol 1991; 13: 665-671.
- http://www.eurasyp.org/public.technique.home.screen, «Determination of glucans and mannans in yeast cell walls (YCW)», 2005.
- Van Rinsum J.; Klis F. «Cell wall glucomannoproteins of Saccharomyces cerevisiae mnn9». Yeast 1991; 7: 717-726.
- Magnelli P.; Cipollo J.; Abeijon C. «A refined method for the determination of Saccharomyces cerevisiae cell wall composition and b1-6 glucan fine structure». Anal Biochem 2002; 301: 136-15
- Swamy H. «Effects of feeding a blend of grains naturally contaminated with Fusarium mycotoxins». J Anim Sci 2003; 81: 2792-2803.
- Akay V.; Dawson D. «Mycotoxins and milk safety, Proceeding of Alltech 19th Annual Symposium», 2003.
- Romero R.; Gómez Basauri J. «Yeast and yeast products, past, present and future, Proceeding of Alltech 19th Annual Symposium», 2003.
- Hooge D. «Meta-analysis of broiler chiken pen trials evaluating dietary mannan oligosaccharide». Intl J Poult Sci 2004; 3: 179-188.