Introducción
La disponibilidad de agua en vid es uno de los factores limitantes más importantes en la viticultura de climas semiáridos mediterráneos, ya que condiciona en gran medida el rendimiento, la concentración de sólidos solubles de las uvas y otros parámetros de calidad como la concentración de ácidos y fenoles.1-3 Por este motivo, en la viticultura de climas cálidos y templados, se considera fundamental caracterizar el estado hídrico de las cepas para la gestión y estudio del viñedo.
El seguimiento del estado hídrico se suele llevar a cabo mediante medidas de potencial hídrico con cámara de presión, o mediante el uso de sensores que, instalados en campo, proporcionan una estimación, generalmente indirecta, del estado hídrico de las plantas. Sin embargo, este tipo de seguimiento resulta costoso en términos de equipamiento necesario, de tiempo invertido en la realización de las medidas, o de ambos. Por ello, en ocasiones puede ser suficiente con disponer de una caracterización del estado y no ser necesario disponer de un seguimiento de la evolución del estado hídrico a lo largo de la campaña. La determinación del ratio isotópico del carbono (δ¹³C) en muestras de uva o mosto integra el estado hídrico de las cepas a lo largo del ciclo vegetativo, y puede ser una alternativa o un complemento al seguimiento tradicional del estado hídrico de las cepas.
El objetivo de este artículo es explicar, de manera resumida, los siguientes aspectos de la determinación del ratio isotópico de carbono:
. Qué es la discriminación isotópica y qué son los ratios isotópicos
. Justificación de por qué el ratio isotópico de carbono esté relacionado con el estado hídrico de la planta.
. Cómo preparar las muestras de uva y mosto para su posterior análisis.
. Cómo es posible medir la composición isotópica de carbono (funcionamiento del analizador).
. Aportar ejemplos de utilidades que esta técnica podría tener para el sector vitivinícola.
La discriminación isotópica. Conceptos generales
Para entender en qué se basan los métodos de determinación de la composición isotópica, es necesario conocer en primer lugar la definición de isótopo. Así, se denomina isótopo de un mismo elemento a aquellos átomos cuyos núcleos tienen el mismo número de protones pero una cantidad diferente de neutrones, y por lo tanto, difieren en número másico.
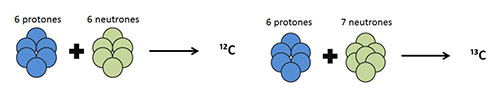
En el caso del carbono, elemento al que hace referencia este trabajo, existen en la naturaleza únicamente dos isotopos estables: el más abundante es el ¹²C (98,899%) y el minoritario el ¹³C (1,111%) (fig. 1). El ¹⁴C, utilizado para la datación de materiales, es también un isótopo del carbono, pero en este caso se trata de un isótopo no estable o radioactivo, al que no haremos referencia en este trabajo.
Conocer los ratios isotópicos no tendría demasiado interés si no fuera por el hecho de que en muchos de los procesos físicos, químicos o fisicoquímicos se ven favorecidas algunas de las formas isotópicas. A este fenómeno, lo denominamos discriminación isotópica, y es gracias a su existencia que conocer la proporción de isotopos estables en cualquier material puede dar una idea de su proceso de formación o evolución.4
Las relaciones isotópicas se expresan en ‰ conforme a la siguiente ecuación:
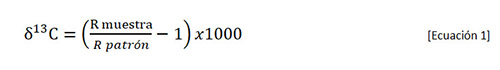
donde

bien sea en la muestra o en el patrón que define el cero de la escala de valores de δ¹³C.
Los valores de δ¹³C se expresan por lo tanto respecto de un patrón aceptado universalmente en la comunidad científica; lo cual permite que dichos valores sean comparables independientemente del laboratorio en el que se realice la medida. De esta manera si el ratio analizado es igual a cero, la composición isotópica es la misma que la del patrón y a medida que los valores de δ¹³C se hacen mayores la muestra se enriquece en el isótopo pesado (¹³C) o empobrece en el ligero (¹²C).
Para el caso del carbono, el patrón primario admitido en la comunidad científica se conoce como PDB (Pee-Dee-Bee);5 un carbonato proveniente de un fósil (Belemnitella americana) del Cretácico, de la formación rocosa PeeDee en Carolina del Sur (EEUU). Este patrón, utilizado por los investigadores americanos para la elaboración de la primera escala de paleo temperaturas, está ya agotado, por lo que ha sido sustituido por otros patrones tales como el VPDB (Vienna Pee-Dee-Bee) que es prácticamente idéntico al PDB, con una razón ¹³C/¹²C de 0,0111797.
Dado que las diferencias en composición isotópica resultantes de los procesos de discriminación son muy pequeñas, no resultaría práctico presentar dichos valores directamente (como abundancia relativa); las diferencias aparecerían en la tercera, cuarta o quinta cifra decimal.
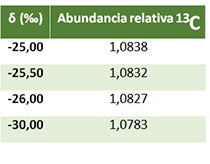
-25,00‰ y -30,00‰
Por ello, cuando se trabaja bajo parámetros de abundancia natural de isótopos, su composición isotópica se expresa casi siempre como δ¹³C según la ecuación 1. En la tabla 1 se indican las abundancias del isótopo pesado ¹³C para valores de δ¹³C comprendidos entre -25,00‰ y -30,00‰. En el apartado siguiente se presenta, de manera resumida, cómo se produce la discriminación isotópica del carbono durante el proceso de fijación del carbono durante la fotosíntesis y cómo dicha discriminación depende del estado hídrico acumulado del cultivo, por lo que puede resultar de interés para el sector vitivinícola.
Discriminación isotópica del carbono durante la fotosíntesis
El carbono presente en el CO2 de la atmosfera es mayoritariamente ¹²C (alrededor del 99%), y solo poco más del 1% aparece en la de ¹³C.6 Sin embargo, cuando se cuantifican las concentraciones de ¹²C en los tejidos vegetales, se observa que la proporción de ¹³C es menor que la del CO2 atmosférico. Por tanto, se deduce que cuando las plantas realizan la fotosíntesis incorporando CO2 atmosférico, se produce una discriminación a favor del ¹²C, que favorece la asimilación de las moléculas de CO2 en las que el carbono es ligero (¹²CO2) frente a la de aquellas que presentan carbono del isótopo pesado (¹³CO2). Diversas investigaciones7,8 han permitido demostrar que esta discriminación está producida básicamente por dos procesos: (i) la mayor afinidad de la Rubisco, enzima encargada de la fotosíntesis, por el ¹²CO2 que por el ¹³CO2, y (ii) la mayor velocidad de difusión por el interior de la hoja (mesófilo) del ¹²CO2. Esto hace que los valores de Δ¹³C de los tejidos vegetales muestren siempre valores negativos, ya que la proporción de ¹³C en un tejido vegetal es menor que la de la atmósfera y que la del material de referencia (PDB).
Por lo tanto, dado que la composición isotópica del C de las moléculas del CO2 atmosférico es estable, las diferencias de composición isotópica de los tejidos vegetales han de deberse necesariamente a estos procesos de discriminación isotópica.
Sabiendo que la proporción de ¹³C del CO2 atmosférico es relativamente estable, la huella isotópica producida por un tejido vegetal a lo largo del ciclo de cultivo puede ser un buen indicador de las condiciones hídricas en las que se ha desarrollado la actividad fotosintética durante su formación y desarrollo. Se ha demostrado que cuando las plantas experimentan cierto déficit hídrico, se produce un cierre estomático y la discriminación isotópica asociada a la fotosíntesis disminuye dado que, progresivamente, la proporción de CO2 con ¹³C dentro de la hoja aumenta respecto a la del CO2 con ¹²C. Este cambio de proporción ocurre porque el ¹²CO2 se va consumiendo más rápidamente por la propia fijación fotosintética, ya que la enzima encargada de la fijación del CO2 (Rubisco), como se ha dicho, tiene preferencia por el ¹²CO2. Además, el efecto de difusión pierde la importancia al no haber renovación del aire de la cavidad subestomática, por estar los estomas cerrados. Es por ello que, en consecuencia, los tejidos de las plantas que han sido sometidas a un déficit hídrico mayor presentan habitualmente valores de δ¹³C más altos (menos negativos) que los procedentes de plantas menos estresadas. Este comportamiento ha sido referido en numerosas ocasiones para el cultivo de la vid,9-18 por lo que resulta de interés profundizar en su estudio y difundir sus posibilidades de utilización.
Preparación de muestras de uva y mosto
La determinación del δ¹³C puede hacerse bien a partir del análisis de las uvas enteras o bien a partir de mosto. En el caso de trabajar con uvas enteras, es necesario secarlas en estufa hasta peso constante, para luego molerlas hasta formar un polvo fino, del que se emplearán entre 2-4 mg para las medidas. Dicha cantidad de muestra se pesa sobre cápsulas de estaño (pureza del 97,5%), que a su vez se cierran con la ayuda de unas pinzas dándoles forma esférica.
En el caso de trabajar con mosto, la preparación se simplifica, de tal manera que el proceso consiste en pipetear 40 microlitros sobre cápsulas de estaño dispuestas en los pocillos de una micro placa tal y como se detalla en la figura 2. Posteriormente se introduce la micro placa en la estufa a 50 ºC durante 24 horas con el fin de evaporar el agua del mosto. Finalmente se procede al cierre de las cápsulas con su correspondiente residuo seco al igual que en el caso anterior. Durante la manipulación de las cápsulas con las pinzas es importante extremar el cuidado para evitar roturas a la hora del cierre de las mismas y/o problemas de contaminación cruzada.

Análisis comparativos realizados por nuestros equipos de investigación (UPNA y CEBAS/CSIC) sobre muestras de uva y de mosto, han demostrado que la información aportada en ambos casos es similar; por lo que habitualmente se trabaja con mosto.
Funcionamiento y fundamento del equipo
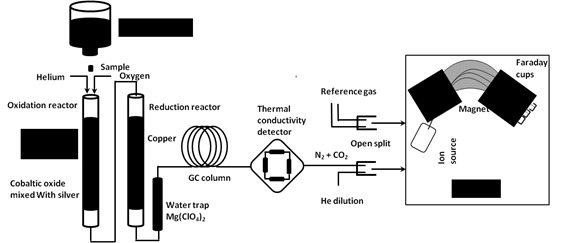
La determinación de δ¹³C se hace sobre los gases CO2 resultantes de la combustión completa de las cápsulas con muestras de mosto, previamente desecadas en la estufa y convenientemente plegadas. La combustión se lleva a cabo en el analizador elemental, en nuestro caso un CARBO ERBA (EA 1108 CHNS/O), y, posteriormente, el CO2 generado es separado cromatográficamente, introducido en el IRMS para el análisis de los isotopos de carbono a través del sistema intermedio denominado ConFlo ll. A continuación, se describen en detalle tanto el equipo como el proceso.
El analizador elemental acoplado a espectrómetro de masas de relaciones isotópicas está formado por tres partes:
- Analizador elemental
En esta primera etapa, se produce una combustión oxidante de la muestra para la extracción de una pequeña cantidad de CO2 en presencia de Cr2O3, oxido de Co/Ag y exceso de O2. Como resultado de esta etapa, a la salida del tubo de oxidación se tiene una mezcla de los siguientes gases: NO + CO2 + O2+ H2O (los óxidos de azufre quedan adsorbidos en el óxido de Co/Ag). Seguidamente tiene lugar una reducción sobre tubo lleno de Cu⁰, donde los diferentes óxidos de nitrógeno son reducidos y el exceso de O2 atrapados como CuO; pasando a tener una mezcla de N2 +CO2+ H2O que pasa a través de la trampa de donde es retenida el agua. Mg (ClO4)2 donde es retenida el agua.
La mezcla de gases resultante: N2 + CO2 pasa por una columna cromatográfica donde son separados.

- ConFlo II
Actúa como interfase de acople entre el Analizador elemental y el espectrómetro de masas además de hacer llegar los pulsos de N2 y CO2 procedentes de las balas del laboratorio y que en el análisis son empleados como gases de referencia, también adecua el flujo de trabajo del analizador elemental al espectrómetro de masas.
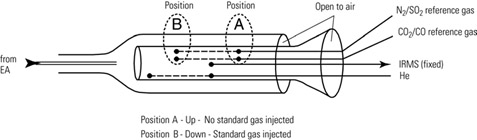
|
- Espectrómetro de masas isotópico
Este equipo consta de una fuente de ionización por impacto electrónico, un analizador de sector magnético y por ultimo tres copas de Faraday que trabajan como detectores.
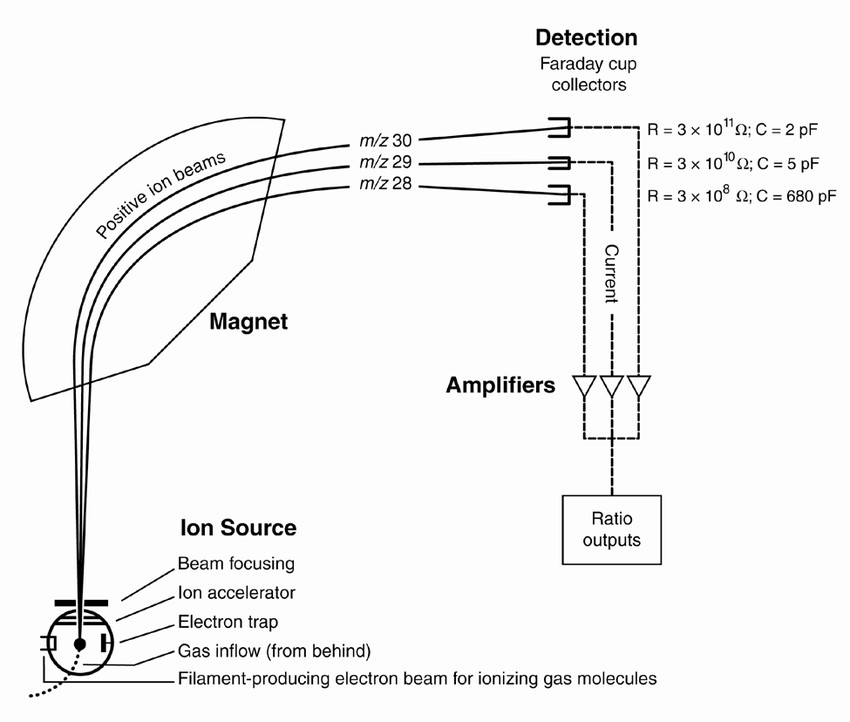
Aquí los gases son ionizados por impactos electrónicos formándose CO2+. Estos iones, por la acción de un campo electromagnético, se hacen llegar al detector que es capaz de registrar determinadas masas presentes en el CO2
Gas CO2: 44(¹²C ¹⁶O ¹⁶O) 45 (¹³C¹⁶O¹⁶O y ¹²C ¹⁷C¹⁶O), y 46 (¹²C ¹⁶O ¹⁸O) resultantes de las posibles combinaciones de los isotopos
¹⁷O, ¹⁶O, ¹⁸O, ¹³C y ¹²C
Por último en la figura 6 se presenta todas las partes del EA-IRMS, en su conjunto y su funcionamiento esquematizado.
Ejemplos de utilización e interés científico
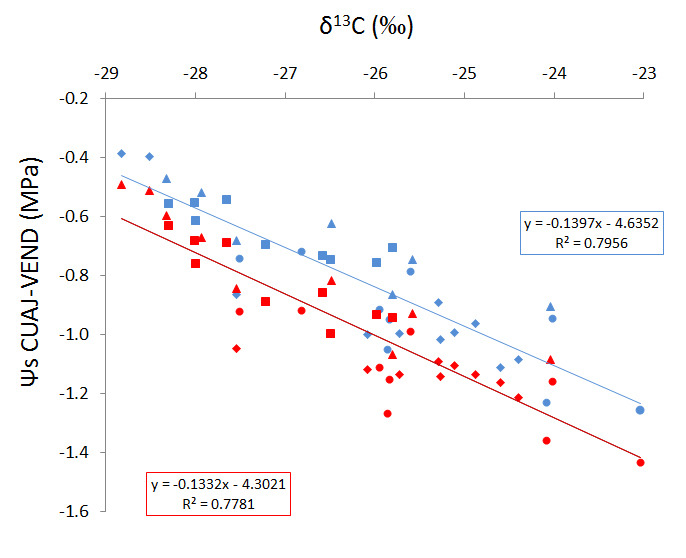
En la figura 7 se representa la relación encontrada entre el ratio isotópico de carbono de bayas en vendimia y los valores medios de potencial hídrico, medidos con una periodicidad semanal, a lo largo de 4 campañas, en tres viñedos de la variedad Tempranillo situados en una explotación vitícola localizada en Traibuenas (Navarra). En cada uno de los tres viñedos, se aplicaron tres estrategias distintas de riego que permitieron tener un amplio rango de estado hídricos de las cepas (fig. 7). Se comprueba que la relación es muy estrecha, lo que indica que, efectivamente, el valor de δ¹³C medido en bayas de tempranillo en vendimia integra muy bien cuál ha sido el estado hídrico del cultivo a lo largo de la campaña, y se confirma que dicho valor puede utilizarse como un indicador de estrés a posteriori. Una descripción más detallada de este trabajo puede encontrarse en Santesteban et al. (2012).13
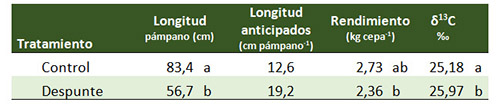
Además de permitir caracterizar diferencias en el estado hídrico propiciadas por diferencias en la estrategia de riego, las medidas de δ¹³C pueden servir para comparar las implicaciones que otras operaciones de cultivo tienen sobre el régimen hídrico de las cepas, a menudo efectos más sutiles pero relevantes. A modo de ejemplo, en la tabla 2 se presentan los valores de δ¹³C observados en un ensayo en el que, al objeto de retrasar la maduración, se practicaba un despunte severo durante la fase de crecimiento inicial de las bayas. Se comprueba como las cepas en las que se ejecutó el despunte tuvieron una mayor disponibilidad de agua a lo largo del ciclo (δ¹³C más negativo), como consecuencia de su menor superficie foliar (que hace que las plantas transpiren menos y, por tanto, gasten menos agua) y de su menor rendimiento (las bayas crecieron menos, y las necesidades agua de la planta eran también menores). Los resultados de este trabajo pueden consultarse más en detalle en Santesteban et al. (2017).20
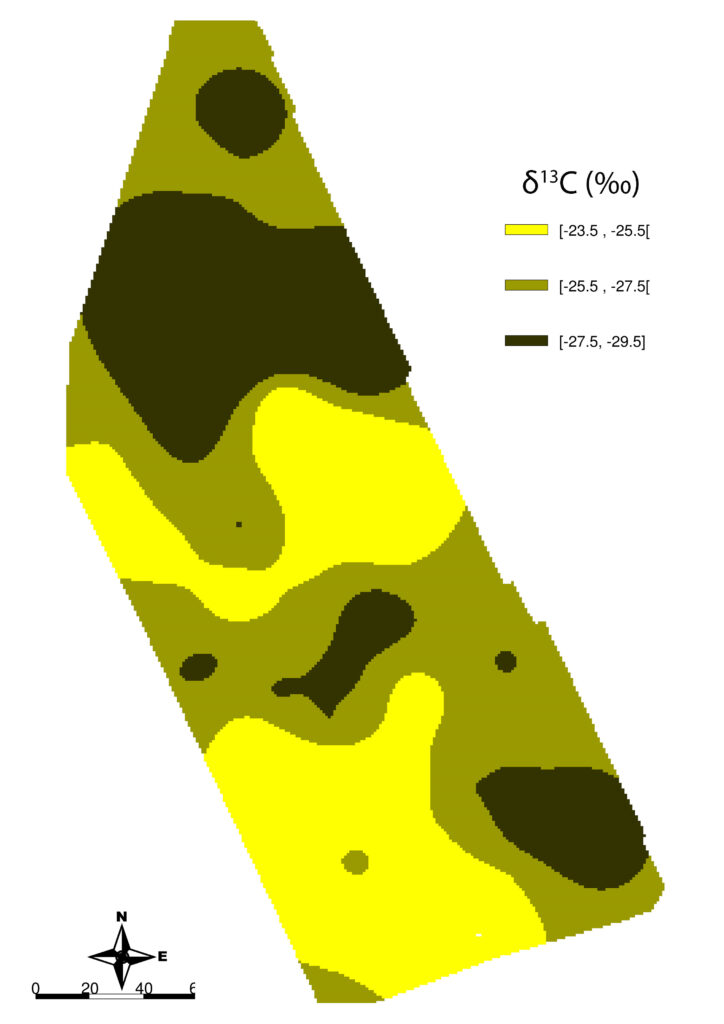
Dentro del ámbito de la denominada viticultura de precisión, es posible utilizar la medida del δ¹³C para el mapeado de la variabilidad del estrés hídrico dentro de una parcela. Dichos mapas, dado el carácter estable de las zonas definidas, pueden usarse tanto para modelización14,21 como para el establecimiento de acciones correctoras en la instalación de riego.
En la figura 8 se presenta el mapa de δ¹³C obtenido en una parcela de 4,2 ha a partir de una malla de 60 puntos de muestreo. De manera paralela, mediante medidas semanales del potencial hídrico en 10 puntos de muestreo, para comprobar si existía correspondencia entre el estado hídrico estimado por ambos procedimientos, comprobando que al igual que ocurría en los ensayos descritos anteriormente, las diferencias de estado hídrico que aparecen de manera natural pueden caracterizarse bien mediante la medida del δ¹³C. En Urretavizcaya et al. (2013)22 puede consultarse con detalle este trabajo.
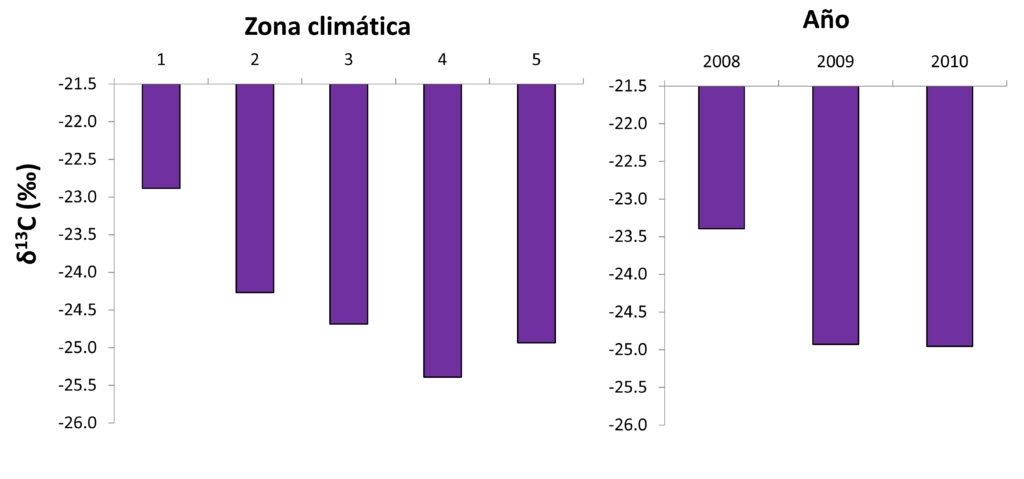
Además de poder utilizarse a escala de explotación vitícola o de parcela, el ratio isotópico del carbono también puede tener interés para caracterizar el estado hídrico que han experimentado las cepas a lo largo de una campaña a nivel regional. El equipo de la Universidad Pública de Navarra, durante el periodo 2008-2010, evaluó la variabilidad que puede encontrarse en δ¹³C a escala regional. Para ello se utilizó la información recopilada en el conjunto de más de 300 viñedos integrados dentro de la red de parcelas VitMod, que se repartían por toda las subzonas de La Rioja y de Navarra. Dichos viñedos se clasificaron en 5 grupos o zonas (la zona 1ª es la más fresca y la 5ª la más cálida). El rango de valores de δ¹³C observados en el conjunto de las parcelas fue muy amplio, oscilando entre -18‰ medido en las parcelas de la Zona 1ª el año más frío (2008) y -29‰ observados los tres años en algunas de las parcelas de las Zonas 4ª y 5ª.
En la figura 9 se representan los valores medios de δ¹³C en cada zona climática y se observa que hay una buena correspondencia entre dichos valores y las características climáticas. Las uvas procedentes de las zonas más frescas (1ª y 2ª), muestran valores más altos que las de las más cálidas (3ª y 5ª). Es destacable que el valor medio de δ¹³C es más negativo en la zona 4ª que en la 5ª lo cual se explica por el hecho de que la totalidad de los viñedos analizados en esta zona están en regadío y se compensa el déficit hídrico mediante aportaciones de agua en verano, mientras que muchos de los viñedos de la zona 4ª estaban en secano y, por tanto, a pesar de que el clima era algo menos cálido, estaban sometidas a un estrés mayor. En la figura 9 se representan los valores medios de δ¹³C de cada año del estudio y, como en el caso anterior, se comprueba una buena correspondencia con las circunstancias climáticas de manera que el valor mayor, se observa el año 2008 que, como ya se ha dicho, fue el más fresco y lluvioso durante el ciclo de la vid.
Agradecimientos
Este trabajo ha sido fruto de una colaboración enmarcada en la Red de Excelencia en Viticultura “RedVitis” (AGL2015-70931-REDT) y del Proyecto “Sostgrape” (AGL2014-54201-C4-4-R), financiados por el Ministerio de Economía Industria y Competitividad y por fondos FEDER.
Bibliografía
1. Santesteban LG, Royo JB. Water status, leaf area and fruit load influence on berry weight and sugar accumulation of cv. “Tempranillo” under semiarid conditions. Sci Hortic (Amsterdam). 2006;109(1):60-65.
2. Van Leeuwen C, Tregoat O, Chone X, Bois B, Pernet D, Gaudillere JP. Vine water status is a key factor in grape ripening and vintage quality for red Bordeaux wine. How can it be assessed for vineyard management purposes? J Int des Sci la Vigne du Vin. 2009;43(3):121-134.
3. Intrigliolo DS, Lizama V, García-Esparza MJ, Abrisqueta I, Álvarez I. Effects of post-veraison irrigation regime on Cabernet Sauvignon grapevines in Valencia, Spain: Yield and grape composition. Agric Water Manag. 2016;170:110-119. doi:10.1016/j.agwat.2015.10.020.
4. Adams MA, Grierson PF. Stable isotopes at natural abundance in terrestrial plant ecology and ecophysiology: An update. Plant Biol. 2001;3(4):299-310. doi:Doi 10.1055/S-2001-16454.
5. Sulzman EW. Stable isotope chemistry and measurement: a primer. In: Michener R, Lajha K, eds. Stable Isotopes in Ecology and Environmental Science. ; 2007:1-21.
6. Hoefs J. Stable Isotope Geochemistry. Berlin, Heidelberg: Springer Berlin Heidelberg; 2009.
7. Farquhar GD, Ehleringer JR, Hubick KT. Carbon isotope discrimination and photosynthesis. Annu Rev Plant Biol. 1989;40(1):503-537.
8. Farquhar GD, Richards RA. Isotopic composition of plant carbon correlates with water-use efficiency of wheat genotypes. Aust J Plant Physiol. 1984;11(6):539-552. doi:http://dx.doi.org/10.1071/PP9840539.
9. Des Gachons CP, Van Leeuwen C, Tominaga T, Soyer JP, Gaudillere JP, Dubourdieu D. Influence of water and nitrogen deficit on fruit ripening and aroma potential of Vitis vinifera L cv Sauvignon blanc in field conditions. J Sci Food Agric. 2005;85(1):73-85. doi:Doi 10.1002/Jsfa.1919.
10. De Souza CR, Maroco JP, Dos Santos TP, et al. Impact of deficit irrigation on water use efficiency and carbon isotope composition (δ13C) of field-grown grapevines under Mediterranean climate. J Exp Bot. 2005;56(418):2163-2172.
11. Gómez-Alonso S, García-Romero E. Effect of irrigation and variety on oxygen (d18O) and carbon (d13C) stable isotope composition of grapes cultivated in a warm climate. Aust J Grape Wine Res. 2010;16(2):283-289.
12. Gaudillere JP, Van Leeuwen C, Ollat N. Carbon isotope composition of sugars in grapevine, an integrate indicator of vineyard water status. J Exp Bot. 2002;53(369):757-763.
13. Santesteban LG, Miranda C, Urretavizcaya I, Royo JB. Carbon isotope ratio of whole berries as an estimator of plant water status in grapevine (Vitis vinifera L.) cv. “Tempranillo.” Sci Hortic (Amsterdam). 2012;146:7-13.
14. Herrero-Langreo A, Tisseyre B, Goutouly JP, Scholasch T, van Leeuwen C. Mapping grapevine (Vitis vinifera L.) water status during the season using carbon isotope ratio (δ13C) as ancillary data. Am J Enol Vitic. 2013;64(3):307-315.
15. Santesteban LG, Miranda C, Royo JB. Regulated deficit irrigation effects on growth, yield, grape quality and individual anthocyanin composition in Vitis vinifera L. cv. “Tempranillo.” Agric Water Manag. 2011;98(7):1171-1179. doi:10.1016/j.agwat.2011.02.011.
16. De Souza CR, Maroco JP, Dos Santos TP, et al. Partial rootzone drying: regulation of stomatal aperture and carbon assimilation in field-grown grapevines (Vitis vinifera cv. Moscatel). Funct Plant Biol. 2003;30(6):653-662.
17. Santesteban LG, Miranda C, Royo JB. Interest of carbon isotope ratio (δ13C) as a modelling tool of grapevine yield, berry size and sugar content at within-field, winegrowing domain and regional scale. Theor Exp Plant Physiol. 2016;28(2):193-203. doi:10.1007/s40626-016-0067-5.
18. Bchir A, Escalona JM, Gallé A, et al. Carbon isotope discrimination (δ13C) as an indicator of vine water status and water use efficiency (WUE): Looking for the most representative sample and sampling time. Agric Water Manag. 2016;167:11-20. doi:10.1016/j.agwat.2015.12.018.
19. Zhang L. Development and Application of Liquid Chromatography Coupled to Isotope Ratio Mass Spectrometry. 2013.
20. Santesteban LG, Miranda C, Urrestarazu J, Loidi M, Royo JB. Severe trimming and enhanced competition of laterals as a tool to delay ripening in Tempranillo vineyards under semiarid conditions. OENO One. 2017;51(2):191-203. doi:10.20870/oeno-one.2016.0.0.1583.
21. Santesteban LG, Di Gennaro SF, Herrero-Langreo A, Miranda C, Royo JB, Matese A. High-resolution UAV-based thermal imaging to estimate the instantaneous and seasonal variability of plant water status within a vineyard. Agric Water Manag. 2017;183:49-59. doi:10.1016/j.agwat.2016.08.026.
22. Urretavizcaya I, Santesteban LG, Guillaume S, Royo JB, Miranda C, Tisseyre B. Prediction of spatial variability of water status in a rain fed vineyard in Spain. In: Stafford J V, ed. Precision Agriculture 2013. Lleida – Spain: Wageningen Academic Publishers; 2013:459-465.
23. Muccio Z, Jackson GP. Isotope ratio mass spectrometry. Analyst. 2009;134(2):213-222. doi:10.1039/B808232D.