La fermentación maloláctica (FML) consiste en la transformación del ácido málico presente de forma natural en el vino en ácido láctico y CO2. Esta reacción de descarboxilación está catalizada por el enzima maloláctico presente en todas las especies de bacterias lácticas (BL) asociadas a la vinificación.1 Las principales implicaciones tecnológicas de la FML en los vinos son: reducción de la acidez, modificación de los compuestos aromáticos, y estabilización microbiológica. La reducción de la acidez es de gran interés para mejorar el gusto de aquellos vinos que tienen una excesiva acidez total. Esta mejora del gusto está relacionada no solo con la disminución de la sensación ácida sino también porque el sabor del ácido málico (herbáceo) es menos agradable que el sabor del ácido láctico (lácteo). La modificación de compuestos aromáticos no es consecuencia directa de la FML sino de la utilización de otros sustratos por las bacterias durante su crecimiento en el mosto o el vino, como por ejemplo, el ácido cítrico que puede dar lugar a diacetilo, acetoína y 2,3-butanodiol.2
Basándonos en lo anterior, deduciríamos que el papel de las BL en vinificación es beneficioso. Sin embargo, nada más lejos de la realidad, las BL tienen una doble cara, que impide considerarlas como “amigas” incondicionales.
«Un vino en el que se han consumido todos los azúcares durante la FA presenta una probabilidad de sufrir alteraciones muchísimo más baja de aquellos en los que se ha producido una parada de fermentación o en los que ha quedado una cierta cantidad de azúcares residuales que no han podido ser consumidos por las levaduras.»
Las alteraciones que pueden producirse en el vino alrededor del proceso de FML dependen fundamentalmente de la existencia de sustratos capaces de ser metabolizados en ese momento por las bacterias lácticas, por levaduras residuales que hayan sobrevivido a la FA o por las bacterias acéticas. Un vino en el que se han consumido todos los azúcares durante la FA presenta una probabilidad de sufrir alteraciones muchísimo más baja de aquellos en los que se ha producido una parada de fermentación o en los que ha quedado una cierta cantidad de azúcares residuales que no han podido ser consumidos por las levaduras. Además de los azúcares, otros sustratos, como los aminoácidos, los ácidos orgánicos propios de los vinos, el glicerol y el etanol originados por las levaduras y el ácido sórbico que es un antiséptico que se puede añadir al vino, pueden ser utilizados por los microorganismos y producir alteraciones organolépticas perjudiciales y también compuestos tóxicos para los consumidores.
Los tipos de microorganismos que pueden estar presentes en el vino tras la FML dependen de las características del mismo, de la evolución de la FA y de las medidas de protección que se le hayan aplicado al vino. Lo habitual es que en esa etapa queden algunas levaduras fermentadoras (S. cerevisiae) aunque en baja concentración (igual o inferior a 105 ufc/mL) Ribéreau-Gayon, Dubordieu, Donèche y Lonvaud,3 pero también existir diversas especies de Brettanomyces o de Pichia o Candida, de metabolismo oxidativo, que pueden desarrollarse si el vino está en contacto con el aire.4 Igualmente, si esto ocurre, pueden desarrollarse bacterias acéticas, fundamentalmente Acetobacter aceti, Acetobacter pasteurianus e incluso Gluconobacter oxydans, que es una especie presente habitualmente en mostos.5,6
El crecimiento de estas bacterias también puede producirse tras el trasiego, que es una práctica que aumenta los niveles de oxígeno en el vino. Aunque durante la FML la especie de BL más frecuente es Oenococcus oeni, también pueden desarrollarse otras especies de como Lactobacillus fructivorans, Lactobacillus hilgardii, Lactobacillus brevis o Pediococcus damnosus.7,8 Las alteraciones más comunes en el periodo que transcurre entre el final de la FA y el comienzo de la FML están causadas por BL. Este hecho unido a que las alteraciones causadas por levaduras y bacterias acéticas ya han sido descritas en los artículos de Guillamón9 y Portillo y Lleixa,10 aparecidos en el número 154 de la Revista ACE, justifica el que aquí se presenten únicamente las alteraciones que pueden provocar las BL.
Alteraciones derivadas de altos niveles de azúcares residuales durante la FML
Si durante la FA se produce una parada de fermentación por agotamiento precoz de la levadura o si esta es incapaz de consumir la totalidad de azúcares, se produce un escenario peligroso en el que las BL pueden desarrollarse, libres de la competencia con S. cerevisiae y metabolizar los azúcares que no han sido fermentados. La utilización de los azúcares por las BL pueden dar lugar a varios tipos de alteraciones: el picado láctico, la vuelta manítica y el ahilado o grasa.
La alteración denominada picado láctico se caracteriza por un incremento significativo de la concentración de ácido láctico y, en algunas ocasiones, de ácido acético.11 Estos ácidos se originan como resultado del catabolismo de las hexosas y pentosas del vino por las bacterias lácticas. Si las bacterias que atacan estos azúcares son de metabolismo homofermentador, solo se producirá ácido láctico, pero si son de metabolismo heterofermentador, además de ácido láctico se generará ácido acético.2,11 A esta alteración se la conoce con el nombre de picado láctico y se caracteriza por un aumento de la acidez fija y, a veces, de la acidez volátil del vino.11 Para evitar el picado láctico es necesario un estricto seguimiento de la FA, sobre todo cuando se trabaja con una vendimia muy madura que va a dar lugar a vinos de alto contenido en azúcar y una baja acidez, condiciones que predisponen a paradas de fermentación y al crecimiento bacteriano en una fase de fermentación inadecuada. Los vinos dulces fortificados también son susceptibles de sufrir esta alteración. Estos vinos suelen contener altas concentraciones de etanol y altas concentraciones de azúcares. Ciertas bacterias, como L. hilgardii y L. fructivorans, son capaces de desarrollarse en este tipo de vinos a pesar de su alta graduación alcohólica, dando lugar al picado láctico.12
La alteración, denominada vuelta manítica, ocurre principalmente en vinos dulces o vinos que tienen un pH alto y contienen cantidades significativas de fructosa residual. Las bacterias heterolácticas, como O. oeni, Lactobacillus brevis y L. hilgardii, tienen la capacidad de transformar la fructosa del mosto o del vino en manitol gracias a la acción del enzima manitol-deshidrogenasa.13 La presencia de manitol confiere un gusto agridulce al vino.11 La canalización de la fructosa hacia manitol o ácido láctico dependerá de la relación de concentraciones entre las especies reducidas y oxidadas de los cofactores NAD y NADP.13
Los vinos que presentan la alteración denominada ahilado o grasa se caracterizan por exhibir una textura viscosa u oleosa. Esta textura es consecuencia de la formación de exopolisacáridos (EPS). Estos EPS pueden estar constituidos por un único tipo de unidad básica (homopolisacáridos) o por varios tipos (heteropolisacáridos). Las especies de BL capaces de producir EPS en el vino son P. damnosus, P. parvulus y O. oeni.14-16 El tipo de EPS más frecuentemente producido por las BL del vino son homopolisacáridos tipo b-glucano, aunque algunas bacterias también producen heteropolisacáridos, como O. oeni.17 El enzima implicado en la producción de los b-glucanos es una glicosil-transferasa 18 cuyos sustratos son glucosa y fructosa, los principales azúcares residuales en el vino.14 La alteración puede ocurrir en los tanques al final de la FA, pero la mayoría de los problemas se producen en vinos embotellados. En general, un vino ahilado no presenta ningún otro defecto organoléptico y puede comercializarse tras un adecuado tratamiento que suele consistir en agitación del vino y posterior sulfitado y filtración que evite posteriores reinfecciones antes de ser embotellado. También puede realizarse un tratamiento de calor antes del embotellado a fin de proteger a estos vinos.2
Alteraciones y toxinas derivadas del metabolismo de aminoácidos
Los aminoácidos son el tipo de compuesto nitrogenado más prevalente en el mosto y en el vino. Su concentración varía entre 1-4 g/L.19 Proceden de la materia prima y de la lisis de los microorganismos, fundamentalmente de las levaduras tras la FA.20 En el vino existen 20 aminoácidos, de ellos los más abundantes son la prolina y la arginina.21 Estos aminoácidos pueden ser metabolizados por las bacterias mediante diversas reacciones.22 El metabolismo de los aminoácidos lisina y ornitina por ciertas BL da lugar a la formación de 2acetiltetrahidropiridina, 2-acetil-1-pirrolina y 2-etiltetrahidropiridina que confieren al vino un desagradable olor a ratón.23 Las bacterias responsables de la formación de estos compuestos son O. oeni, Leuc. mesenteroides, L. hilgardii, Lactobacillus brevis y L. cellobiosus.11,23 Esta alteración no es muy común y suele ocurrir con mayor probabilidad en vinos de baja acidez insuficientemente sulfitados.11
Los aminoácidos son utilizados por los microorganismos del vino para construir sus propias proteínas y elementos estructurales pero también son precursores de las aminas biógenas (AB) y del carbamato de etilo (CE), productos considerados tóxicos para el consumidor. Las reacciones enzimáticas que conducen a la síntesis de estos productos tóxicos son descarboxilaciones, transaminaciones y aminaciones reductivas.24,25 Según se ha descrito las AB afectan las características organolépticas de los vinos26 y, además, provocan diversas alteraciones fisiológicas en los individuos que ingieren alimentos que las contienen.20,27
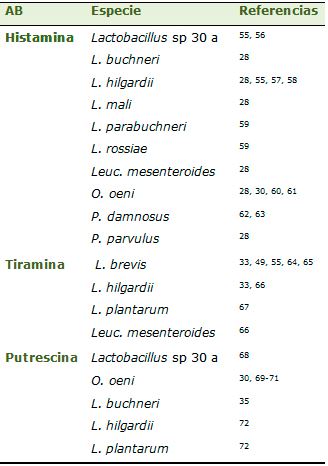
Las aminas biógenas más abundantes en vinos son la putrescina, la histamina, etilamina, isoamilamina y tiramina.20,21 Las más peligrosas desde el punto de vista de la salubridad, son histamina, tiramina, putrescina y cadaverina. La histamina causa dolores de cabeza, palpitaciones, edemas, vómitos, diarreas y disminuye la presión sanguínea. La tiramina produce hipertensión y la putrescina y la cadaverina, aunque no son tóxicas por sí mismas, agravan los efectos tóxicos de la histamina y la tiramina.20 Aunque la producción de aminas es un carácter dependiente de cepa, las especies que producen mayores cantidades de histamina son L. hilgardii, Pediococcus parvulus, Lactobacillus mali; de tiramina y feniletilamina L. brevis y L. hilgardii; de putrescina L. hilgardii y O. oeni28-30 y de cadaverina O. oeni30 (tabla 1).
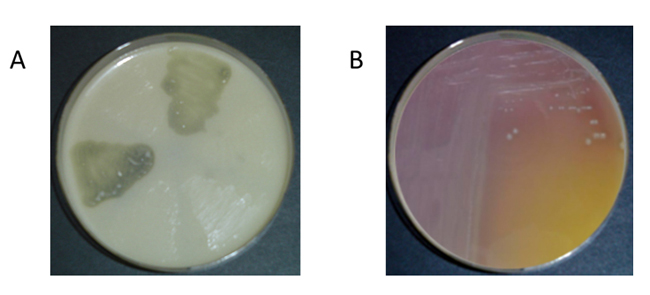
Algunas levaduras también se han revelado como productoras de AB,31,32 aunque su contribución a la síntesis de las mismas es bastante más reducida según Landete, Ferrer y Pardo.33 Existen varios métodos para detectar bacterias potencialmente productoras de aminas biógenas: métodos de detección en placa28,29 (figura 1), métodos enzimáticos,34 métodos cromatográficos,35 ELISA36 y métodos moleculares.37
Las estrategias que se han usado para evitar la acumulación de AB en vinos han sido principalmente preventivas: evitar el crecimiento excesivo de BL más allá de la FML, evitar largas maceraciones con hollejos y eliminar la crianza sobre lías, ya que todas estas prácticas aumentan la concentración de aminoácidos en el vino. Sin embargo, estas estrategias no son fáciles de aplicar, sobre todo cuando lo que interesa es conseguir vinos de “alta expresión”. Muchos vinos calificados como tales presentan altos contenidos de AB. Se han descrito estrategias para reducir el contenido de las AB una vez que estas se han formado en el vino, una de estas estrategias contempla el uso de bentonita o la cola de pescado.27
Otra estrategia recientemente descrita en vinos es el uso de microorganismos propios del entorno vitivinícola, para degradar las AB. Cueva, García-Ruiz, González-Rompinelli, Bartolome, Martín-Álvarez, Salazar, Vicente, Bills y Moreno-Arribas38 consiguieron disminuir los niveles de histamina, tiramina y putrescina en vinos utilizando extractos de una cepa de Penicillium citrinum aislado de un viñedo. Igualmente, Callejón, Sendra, Ferrer y Pardo39 describieron la capacidad de varias cepas de BL del vino para degradar estas tres aminas en vino.
El CE es un compuesto potencialmente carcinógeno. Se produce como consecuencia de una reacción no enzimática entre el etanol del vino y compuestos que contienen un grupo carbonilo, tales como la urea, la citrulina y carbamil fosfato, todos ellos productos intermediarios del catabolismo de la arginina, uno de los aminoácidos más abundantes en el vino;21 mientras que la urea es producida por las levaduras, los otros dos intermediarios proceden de las BL25.40 Las especies bacterianas capaces de producir estos precursores son L. hilgardii y O. oeni.12,41 La única forma de evitar que existan altos niveles de CE en vino es evitar la presencia de sus precursores mediante el uso de cultivos iniciadores de levaduras y bacterias malolácticas adecuadas.
Alteraciones derivadas del metabolismo de los ácidos orgánicos
Los principales ácidos orgánicos presentes en el vino son el ácido tartárico, el málico, el láctico y el cítrico. En menores concentraciones se encuentran otros muchos.21 El citrato puede utilizarse solo o en cometabolización con hexosas, dependiendo de la especie de BL, mientras que los ácidos: málico, tartárico pirúvico y tartárico, pueden degradarse sin necesidad de un cosustrato. La degradación de estos ácidos puede proporcionar cierta energía a las BL, aunque de todos los ácidos presentes en el vino, solo el ácido pirúvico puede sustentar el crecimiento de O. oeni cuando se suministra como único sustrato.42
Existen pocas especies de BL capaces de degradar el ácido tartárico y todas ellas se encuentran dentro del género Lactobacillus. De las 78 cepas de pediococos, lactobacilos y leuconostoc examinadas por Radler y Yannissis43 solamente cuatro cepas de L. plantarum y una de L. brevis metabolizaban este ácido. La ruta de degradación en ambas especies difiere, de forma que en L. plantaron, y también en O. oeni, los productos finales son ácido láctico, acético y CO2, mientras que en L. brevis se produce ácido succínico, acético y CO2.11,42 Las consecuencias de esta alteración, denominada vuelta tartárica, son la disminución de la acidez fija y aumento de la acidez volátil del vino.2 Este ácido se degrada solo bajo condiciones muy específicas y tras la degradación de otros ácidos orgánicos.42
«La producción de etanol o lípidos no afecta ni positiva ni negativamente, pero la de ácido acético incrementa la acidez volátil de los vinos y, por tanto, es perjudicial.»
El metabolismo del ácido cítrico puede conducir a productos de naturaleza muy diversa: 2,3 butanodiol, etanol, ácido acético y lípidos. Dependiendo del producto de destino de este ácido las características del vino pueden mejorar o empeorar. Así, si se produce 2,3 butanodiol mejora la complejidad organoléptica de los vinos confiriéndoles notas a mantequilla, aunque si la concentración de este producto es alta (superior a 4 mg/L), esto se convierte en un problema más que en una ventaja.23 La producción de etanol o lípidos no afecta ni positiva ni negativamente, pero la de ácido acético incrementa la acidez volátil de los vinos y, por tanto, es perjudicial. Parece ser que las condiciones que favorecen el crecimiento de las bacterias favorecen la síntesis de ácido acético, etanol y lípidos, mientras que aquellas que limitan el crecimiento conducen a la síntesis de 2,3 butanodiol.2
El ácido sórbico es un ácido que no existe de manera natural ni en el mosto ni en el vino, pero que en países cuya legislación lo permite se puede usar como antimicrobiano para evitar refermentaciones causadas por las levaduras. Las concentraciones que se suelen usar (200 mg/L) no son activas frente a las BL. El metabolismo de este ácido comporta la transformación del ácido sórbico a sorbinol, que en un ambiente ácido como lo es el vino, se isomeriza a 3,5-hexadieno-2-ol, el cual reacciona con el etanol para formar el 2-etoxi-3,5-hexadieno que confiere olor a hojas de geranio cortadas.11,23 Radler44 demostró que todas las cepas de O. oeni y algunas cepas de lactobacilos heterofermentativos analizadas por él, podían reducir el ácido sórbico a sorbinol. Posteriormente, Edinger y Splittoesser45 confirmaron los resultados de Radler44 para las especie O. oeni pero no para Lactobacillus y demostraron, además, que las cepas de Pediococcus tampoco llevaban a cabo esta reducción.11 La presencia de este compuesto es detectable a muy bajas concentraciones (0,1 mg/L), de ahí su peligrosidad.
Alteración derivada del metabolismo del glicerol
En el vino existe glicerol en concentraciones que van de 5 a 8 g/L y contribuye de forma importante al gusto y a las sensaciones táctiles. Este compuesto lo producen las levaduras como producto secundario de la FA.46
El amargor es una alteración producida por la transformación del glicerol en acroleína por bacterias lácticas. La acroleína no es amarga por sí misma pero reacciona con los grupos fenólicos de los taninos dando sensación de amargor. Por esta razón esta alteración es más frecuente en vinos tintos que presentan mayor cantidad de polifenoles que los vinos blancos.11 Su umbral de detección es bajo (10 ppm). La capacidad de degradar el glicerol no está muy extendida entre las bacterias lácticas, sin embargo se ha encontrado que algunas cepas de P. parvulus, Leuc. mesenteroides y Lactobacillus cellobiosus sí la presentan.11
Alteración derivada del metabolismo de los ácidos fenólicos carboxílicos
Los ácidos fenólicos carboxílicos (ácido ferúlico y cumárico) son constituyentes naturales del mosto de uva y del vino. Ambos ácidos pueden ser descarboxilados por bacterias de las especies L. brevis, L. plantarum y por otras del género Pediococcus. La descarboxilación de estos ácidos va acompañada de la formación de fenoles volátiles (4-etilfenol y 4,3-etilguayacol). O. oeni solo es capaz de producir estos compuestos cuando se permeabilizan sus células, lo que indica que carece de un sistema adecuado para el transporte de los ácidos fenólicos al interior celular.22 Aunque las BL pueden producir olores a fenol en el vino, las principales responsables de su presencia son las levaduras Brettanomyces/Dekker.23
Detección y prevención de estas alteraciones
La detección de los microorganismos causantes de estas alteraciones no es tarea fácil por dos motivos principalmente: uno es que hay alteraciones que pueden ser causadas por un gran número de especies, como es el caso del picado láctico, y otro, porque otras alteraciones son características de cepa, no de especie; ello significa que no todos los individuos de una misma especie pueden dar lugar a estas alteraciones. Alteraciones como el picado láctico o la vuelta manítica pueden ser causadas por varias especies, sobre todo heterofermentativas, que son las que aparecen en etapas tardías de la FA (L. brevis, L. hilgardii, L. fructivorans e incluso O. oeni). Alguna de las metodologías que podrían utilizarse para prever los riesgos de esta alteración sería la PCR cuantitativa utilizando cebadores dirigidos a uno o dos genes que existen en este tipo de bacterias, por ejemplo, los genes que codifican para los enzimas de la 6-fosfo-gluconato deshidrogenasa y de la xilulosa 5-fosfato fosfocetolasa, que son exclusivos de las bacterias heterofermentadoras, tanto estrictas como facultativas. Para la detección de aquellas alteraciones que son producidas por cepas de determinadas especies se recurre muchas veces a la detección de los genes que codifican para los enzimas responsables de esa reacción metabólica.
«Alteraciones como el picado láctico o la vuelta manítica pueden ser causadas por varias especies, sobre todo heterofermentativas, que son las que aparecen en etapas tardías de la FA.»
Ejemplos de este tipo de estrategia son la detección/cuantificación de cepas productoras de exopolisacáridos, que se basa la detección del gen gtf que codifica para la glicosil-transferasa responsable de la síntesis de b-glucanos en P. damnosus14,47 y también en Lactobacillus diolivorans y O. oeni.48 Otras alteraciones detectables mediante la amplificación de genes responsables de las mismas son la producción de AB, como la histamina, tiramina y putrescina49-51 y la de CE.52 La PCR solo detecta la presencia de un gen o cuantifica a las bacterias portadoras de ese gen, sin poder diferenciar si esas bacterias están vivas o muertas. Dado que solo las bacterias vivas representarían un problema de cara a las alteraciones, se podría aplicar fluorocromos capaces de unirse al DNA de los microorganismos muertos para diferenciar entre células vivas y muertas.53,54
La manera más eficaz de evitar los problemas tras la FA es controlar el desarrollo de los microorganismos que puedan desarrollarse en esta etapa. Este control puede realizarse manejando bien la FA, de manera que durante esta solo se desarrolle una cepa adecuada de S. cerevisiae, que esta agote los azúcares, y que esa cepa no produzca alteraciones organolépticas. También hay que asegurarse de que el período que transcurre entre la FA y la FML sea lo más corto posible y para ello es conveniente inocular cultivos seleccionados de O. oeni, que sean rápidos en metabolizar el ácido málico y que no provoquen desviaciones organolépticas. Tras la FML y durante la crianza es decisivo eliminar cualquier bacteria presente en los vinos, cosa que se puede conseguir mediante el uso del anhídrido sulfuroso o de la lisozima y evitando la exposición al aire del vino para impedir el desarrollo de levaduras oxidativas y bacterias acéticas.
Por todo lo que hemos visto hasta ahora, podemos concluir que el riesgo de sufrir alteraciones microbianas tras la FA va a depender de los sustratos que existan en los vinos y que sean susceptibles de ser metabolizados por los microorganismos presentes en esta fase, que son fundamentalmente bacterias lácticas.
De lo expuesto anteriormente, ha quedado patente que las BL son microorganismos de conveniencia que exhibirán su cara amiga cuando actúen sobre el ácido málico o sobre el ácido cítrico (si la metabolización del mismo conduce a concentraciones adecuadas de acetoína y 2,3-butanodiol) y su cara enemiga cuando lo hagan sobre el resto de sustratos que haya en el vino.
Bibliografía
1. Caspritz G y Radler F, Malolactic enzyme of Lactobacillus plantarum. Purification, properties, and distribution among bacteria. J Biol Chem 258: 4907-4910 (1983).
2. Ribéreau-Gayon J, Dubourdieu D, Donèche B y Lonvaud A, Metabolism of Lactic Acid Bacteria, in Handbook of Enology The Microbiology of wine and vinifications. John Wiley & Sons Ltd., Chichester. England., pp 129-148 (2006).
3. Ribéreau- Gayon J, Dubordieu D, Donèche B y Lonvaud A, Conditions of yeast development, in Handbook of Enology The Microbiology of Wine and Vinifications. John Wiley & Sons, Ltd., Chichester. England., pp 75-106 (2006).
4. Ribéreau-Gayon P, Dubourdieu D, Donèche B y Lonvaud A, Cytology, taxonomy and ecology of grape and wine yeasts, in Handbook of Enology The microbiology of wine and vinifications. John Wiley & Sons Ltd., Chichester. England., pp 1-49 (2006).
5. Ribéreau-Gayon J, Dubordieu D, Donèche B y Lonvaud A, Acetic acid bacteria., in Handbook of Enology The microbiology of wine and vinifications. John Wiley & Sons, Ltd., Chichester. England., pp 169-177 (2006).
6. Blasco L, Aplicación de las técnicas FISH, PCR específica y 16S-ARDRA al estudio de la población bacteriana asociada al proceso de vinificación. Tesis Doctoral Universitat de València (2009).
7. Renouf V, Claisse O, Miot-Sertier C y Lonvaud-Funel A, Lactic acid bacteria evolution during winemaking: Use of rpoB gene as a target for PCR-DGGE analysis. Food Microbiol 23: 136-145 (2006).
8. Ribéreau-Gayon P, Dubordieu D, Donèche B y Lonvaud A, Lactic acid bacteria development in wine., in Handbook of Enology The microbiology of wine and vinifications John Wiley & Sons, Ltd., Chichester. England., pp 149-177 (2006).
9. Guillamón JM, Diversidad microbiana y alteraciones durante la fermentación alcohólica: el yin y el yang para el enólogo ACE Revista de Enología (2016). https://www.acenologia.com/cienciaytecnologia/diversidad_microbiana_FA_yinyang_cienc0416.htm
10. Portillo MdC y Lleixa J, Aplicación de técnicas de secuenciación de nueva generación para la detección de Brettanomyces y otros contaminantes microbiológicos en el vino de crianza y durante el embotellado. ACE Revista de Enología (2016). https://www.acenologia.com/cienciaytecnologia/tecnicas_secuenciacion_brett_cienc0216.htm
11. Sponholz WR, Wine spoilage by microorganisms, in In: Wine microbiology and biotechnology, ed. by Fleet GH. Harwood Academic, Switzerland, pp 395-420 (1993).
12. Lonvaud-Funel A, Lactic acid bacteria in the quality improvement and depreciation of wine. Antonie van Leeuwenhoek 76: 317-331 (1999).
13. Maicas S, Ferrer S y Pardo I, NAD(PH regeneration is the key for heterolactic fermentation of hexoses in Oenococcus oeni. Microbiology 148: 325-332 (2002).
14. Walling E, Gindreau E y Lonvaud-Funel A, A putative glucan synthase gene dps detected in exopolysaccharide-producing Pediococcus damnosus and Oenococcus oeni strains isolated from wine and cider. Int J Food Microbiol 98: 53-62 (2005).
15. Dols-Lafargue M, Lee HY, Le Marrec C, Heyraud A, Chambat G y Lonvaud-Funel A, Characterization of gtf, a glucosyltransferase gene in the denomes of Pediococcus parvulus and Oenococcus oeni, two bacterial species commonly found in wine. Appl Environ Microbiol 74: 4079-4090 (2008).
16. Ciezack G, Hazo L, Chambat G, Heyraud A, Lonvaud-Funel A y Dols-Lafargue M, Evidence for exopolysaccharide production by Oenococcus oeni strains isolated from non-ropy wines. J Appl Microbiol 108: 499-509 (2010).
17. Ibarburu I, Soria-Díaz ME, Rodríguez-Carvajal MA, Velasco SE, Tejero-Mateo P, Gil-Serrano AM, Irastorza A y Dueñas MT, Growth and exopolysaccharide (EPS production by Oenococcus oeni I4 and structural characterization of their EPSs. J Appl Microbiol 103: 477-486 (2007).
18. Werning ML, Ibarburu I, Dueñas MT, Irastorza A, Navas J y López P, Pediococcus parvulus gtf Gene Encoding the GTF Glycosyltransferase and Its Application for Specific PCR Detection of B-D-Glucan-Producing Bacteria in Foods and Beverages. J Food Prot 69: 161-169 (2006).
19. Ribéreau-Gayon P, Glories Y, Maujean A y Dubourdieu D, Nitrogen compounds, in Handbook of Enology The chemistry of wines, stabilization and treatments. John Wiley & Sons, Ltd, Chichester. England., pp 99-128. (2000).
20. Landete JM, Ferrer S, Polo L y Pardo I, Biogenic amines in wines from three Spanish regions. J Agric Food Chem 53: 1119-1124 (2005).
21. Cabanis JC, Cabanis MT, Cheynier V y Teissendre PL, Tablas de composición, in Enología: fundamentos científicos y tecnológicos, ed. by Flanzy C. AMV ediciones y Mundi Prensa, Madrid, pp 218-231 (2000).
22. Muñoz R, Moreno-Arribas MV y De las Rivas B, Bacterias Lácticas, in Microbiologia del vino, ed. by Carrascosa A, Muñoz R y González R. AMV Ediciones, Madrid, pp 231-272 (2005).
23. Bartowsky EJ y Pretorius IS, Microbial formation and modification of flavor and off-flavor compounds in wine, in Biology of microorganisms on grapes, in must and in wine, ed. by König H, Unden G y Frölich J. Springer, Berlin, Germany, pp 209-232 (2009).
24. Sebastian P, Herr P, Fischer U y König H, Molecular identification of lactic acid bacteria occurring in must and wine. South African Journal of Enology and Viticulture 32: 300-309 (2011).
25. Mira de Orduña R, Liu S-Q, Patchett ML y Pilone GJ, Ethyl carbamate precursor citrulline formation from arginine degradation by malolactic wine lactic acid bacteria. FEMS Microbiology Letters 183: 31-35 (2000).
26. Palacios A, Suárez C, Krieger S, Theodore D, Otaño L, Laucirica A y Peña F, Influencia organoléptica de las aminas biógenas producidas durante la fermentación maloláctica del vino. ACE Revista de Enologia 70: 14-20 (2005).
27. Woller R, Aminas biógenas: presencia en el vino y efectos en el organismo. ACE Revista de Enología 70: 9-13 (2005).
28. Landete JM, Ferrer S y Pardo I, Which lactic acid bacteria are responsible of histamine production in wine? J Appl Microbiol 99: 580-586 (2005).
29. Landete JM, Pardo I y Ferrer S, Tyramine and phenylethylamine production among lactic acid bacteria isolated from wine. Int J Food Microbiol 115: 364-368 (2007).
30. Guerrini S, Mangani S, Granchi L y Vincenzini M, Biogenic amine production by Oenococcus oeni. Curr Microbiol 44: 374-378 (2002).
31. Caruso M, Fiore C, Contursi M, Salzano G, Paparella A y Romano P, Formation of biogenic amines as criteria for the selection of wine yeasts. World J Microbiol Biotechnol 18: 159-163 (2002). 32. Torrea D y Ancín C, Influence of yeast strain on biogenic amines content in wines: relationship with the utilization of amino acids during fermentation. Am J Enol Vitic 52:185-190 (2001).
33. Landete JM, Ferrer S y Pardo I, Biogenic amine production by lactic acid bacteria, acetic bacteria and yeast isolated from wine. Food Control 18: 1569-1574 (2007).
34. Landete JM, Ferrer S y Pardo I, Improved enzymatic method for the rapid determination of histamine in wine. Food Addit Contam 21: 1149-1154 (2004).
35. Moreno-Arribas MV, Polo MC, Jorganes F y Muñoz R, Screening of biogenic amine production by lactic acid bacteria isolated from grape must and wine. Int J Food Microbiol 84: 117-123 (2003).
36. Marcobal A, Polo MC, Martín-Álvarez PJ y Moreno-Arribas MV, Biogenic amine content of red Spanish wines: comparison of a direct ELISA and an HPLC method for the determination of histamine in wines. Food Res Int 38: 387-394 (2005).
37. de las Rivas B, Marcobal Á y Muñoz R, Improved multiplex-PCR method for the simultaneous detection of food bacteria producing biogenic amines. FEMS Microbiology Letters 244: 367-372 (2005).
38. Cueva C, García-Ruiz A, González-Rompinelli E, Bartolome B, Martín-Álvarez PJ, Salazar O, Vicente MF, Bills GF y Moreno-Arribas MV, Degradation of biogenic amines by vineyard ecosystem fungi. Potential use in winemaking. J Appl Microbiol 112: 672-682 (2012).
39. Callejón S, Sendra R, Ferrer S y Pardo I, Identification of a novel enzymatic activity from lactic acid bacteria able to degrade biogenic amines in wine. Appl Microbiol Biotechnol 98: 185-198 (2014).
40. Lonvaud-Funel A, Lactic acid bacteria in the quality improvement and depreciation of wine. Antonie van Leeuwenhoek 76: 317-331 (1999).
41. Romero SV, Reguant C, Bordons A y Masqué MC, Potential formation of ethyl carbamate in simulated wine inoculated with Oenococcus oeni and Lactobacillus plantarum. Int J Food Sci Tech 44: 1206-1213 (2009).
42. Unden G y Zaunmüller T, Metabolism of sugars and organis acids by lactic acid bacteria from wine and must, in Biology of microorganisms on grapes, in must and in wine, ed. by König H, Unden G y Fröhlich J. Springer, Berlin, Germany, pp 135-148 (2009).
43. Radler F y Yannissis C, Weinsäureabbau bei milchsäurebakterien. Arch Mikrobiol 82: 219-239 (1972).
44. Radler F, Degradation de l’acide sorbique par les bactéries. . Bulletin de l’OIV 49: 629-635 (1976).
45. Edinger WD y Splittoesser DF, Production by lactic acid bacteria of sorbic alcohol, the precursor of the geranium odor compound. Am J Enol Vitic 37: 34-38 (1986).
46. Ribéreau-Gayon P, Dubordieu D, Donèche B y Lonvaud A, Alcoholic fermentation and metabolic pathways, in Handbook of Enology The microbiology of wine and vinifications. John Wiley & Sons Ltd., Chichester. England, pp 51-74 (2006).
47. Walling É, Gindreau E y Lonvaud-Funel A, La biosynthèse d’exopolysaccharide par des souches de Pediococcus damnosus isolées du vin : mise au point d’outils moléculaires de détection. Lait 81: 289-300 (2001).
48. Dols-Lafargue M y Lonvaud-Funel A, Polysaccharide production by grapes, must, and wine microorganisms., in Biology of microorganisms on grapes,in musts and in wine ed. by Köning H, Unden G y Fröhlich J. Springer, Berlin, Germany, pp 241-258 (2009).
49. Lucas P y Lonvaud-Funel A, Purification and partial gene sequence of the tyrosine decarboxylase of Lactobacillus brevis IOEB 9809. FEMS Microbiology Letters 211: 85-89 (2002).
50. Coton E, Rollan G, Bertrand A y Lonvaud-Funel A, Histamine-producing lactic acid bacteria in wines: early detection, frequency, and distribution. Am J Enol Vitic 49: 199-204 (1998).
51. Marcobal Á, Rivas Bdl, Moreno-Arribas MV y Muñoz R, Multiplex PCR method for the simultaneous detection of histamine, tyramine, and putrescine producing lactic acid bacteria in foods. J Food Prot 68: 874-878 (2005).
52. Araque I, Gil J, Carreté R, Bordons A y Reguant C, Detection of arc genes related with the ethyl carbamate precursors in wine lactic acid bacteria. J Agric Food Chem 57: 1841-1847 (2009).
53. Vendrame M, Iacumin L, Manzano M y Comi G, Use of propidium monoazide for the enumeration of viable Oenococcus oeni in must and wine by quantitative PCR. Food Microbiol 35: 49-57 (2013).
54. Andorrà I, Esteve-Zarzoso B, Guillamón JM y Mas A, Determination of viable wine yeast using DNA binding dyes and quantitative PCR. Int J Food Microbiol 144: 257-262 (2010).
55. Costantini A, Cersosimo M, Del Prete V y Garcia-Moruno E, Production of biogenic amines by lactic acid bacteria: screening by PCR, thin-layer chromatography, and high-performance liquid chromatography of strains isolated from wine and must. J Food Prot 69: 391-396 (2006).
56. Moreno-Arribas MV, Polo MC, Jorganes F y Muñoz R, Screening of biogenic amine production by lactic acid bacteria isolated from grape must and wine. Int J Food Microbiol 84: 117-123 (2003).
57. Farías M, Manca de Nadra MC, Rollan GC y Strasser de Saad AM, Histidine decarboxylase activity in lactic acid bacteria from wine. Journal International des Sciences de la Vigne et du Vin 27: 191-199 (1993).
58. Lucas PM, Wolken WAM, Claisse O, Lolkema JS y Lonvaud-Funel A, Histamine-producing pathway encoded on an unstable plasmid in Lactobacillus hilgardii 0006. Appl Environ Microbiol 71: 1417-1424 (2005).
59. Costantini A, Vaudano E, Del Prete V, Danei M y Garcia-Moruno E, Biogenic amine production by contaminating bacteria found in starter preparations used in winemaking. J Agric Food Chem 57: 10664-10669 (2009).
60. Coton E, Rollan GC y Lonvaud-Funel A, Histidine carboxylase of Leuconostoc oenos 9204: purification, kinetic properties, cloning and nucleotide sequence of the hdc gene. J Appl Microbiol 84: 143-151 (1998).
61. Lonvaud-Funel A y Joyeux A, Histamine production by wine lactic acid bacteria: isolation of a histamine-producing strain of Leuconostoc oenos. J Appl Bacteriol 77: 401-407 (1994).
62. Aerny J, Origine de l’histamine dans les vins. Connaissances actuelles. Bull OIV 58: 1016-1019 (1985).
63. Delfini C, Ability of wine malolactic bacteria to produce histamine. Sciences des Aliments 9: 413-416 (1989).
64. Lucas P, Landete J, Coton M, Coton E y Lonvaud-Funel A, The tyrosine decarboxylase operon of Lactobacillus brevis IOEB 9809: characterization and conservation in tyramine-producing bacteria. FEMS Microbiology Letters 229: 65-71 (2003).
65. Moreno-Arribas V, Torlois S, Joyeux A, Bertrand A y Lonvaud-Funel A, Isolation, properties and behaviour of tyramine-producing lactic acid bacteria from wine. J Appl Microbiol 88: 584 – 593 (2000).
66. Moreno-Arribas V, Torlois S, Joyeux A, Bertrand A y Lonvaud-Funel A, Isolation, properties and behaviour of tyramine-producing lactic acid bacteria from wine. J Appl Microbiol 88: 584-593 (2000).
67. Arena M, Fiocco D, de Manca Nadra M, Pardo I y Spano G, Characterization of a lactobacillus plantarum strain able to produce tyramine and partial cloning of a putative tyrosine decarboxylase gene. Curr Microbiol 55: 205 – 210 (2007).
68. Tabor CW y Tabor H, Polyamines in microorganisms. Microbiol Rev 49: 81-99 (1985).
69. Coton E, S. T, Bertrand A y Lonvaud-Funel A, Biogenic amines and wine lactic acid bacteria. Bulletin de la OIV 72: 23-34 (1999).
70. Mangani S, Guerrini S, Granchi L y Vincenzini M, Putrescine accumulation in wine: role of Oenococcus oeni. Curr Microbiol 51: 6-10 (2005).
71. Marcobal A, de las Rivas B, Moreno-Arribas MV y Muñoz R, Identification of the ornithine decarboxylase gene in the putrescine-producer Oenococcus oeni BIFI-83. FEMS Microbiology Letters 239: 213-220 (2004).
72. Arena ME y Manca de Nadra MC, Biogenic amine production by Lactobacillus. J Appl Microbiol 90: 158-162 (2001).