Introducción
Brettanomyces bruxellensis constituye una amenaza permanente para la calidad de los vinos. Estas levaduras de alteración son capaces de desarrollarse en un medio difícil y en cualquier momento de la vida de un vino, particularmente durante la fase de crianza. Actualmente, para luchar contra Brettanomyces se utilizan diferentes medios con mayor o menor éxito, pero no suficientes, pues no existe herramienta totalmente satisfactoria para eliminar estos microorganismos alterantes. Admitido como práctica enológica por la OIV en julio de 2009 y por la Unión Europea en diciembre de 2010, el quitosano de origen fúngico representa una herramienta innovadora y eficaz de lucha contra Brettanomyces. Varios trabajos llevados a cabo en laboratorio mostraban la eficacia del quitosano, y desde 2008, experiencias en condiciones reales de bodega confirman su efectividad en muy diversas condiciones. Todo el conocimiento adquirido a partir de los resultados de estas experiencias han ayudado a los enólogos a refinar sus métodos para monitorizar la efectividad del tratamiento, y han contribuido a comprender el modo de acción del quitosano sobre las células de Brettanomyces.
desarrollarse en un medio difícil y en cualquier momento de la vida de un vino, particularmente durante la fase de crianza. Actualmente, para luchar contra Brettanomyces se utilizan diferentes medios con mayor o menor éxito, pero no suficientes, pues no existe herramienta totalmente satisfactoria para eliminar estos microorganismos alterantes. Admitido como práctica enológica por la OIV en julio de 2009 y por la Unión Europea en diciembre de 2010, el quitosano de origen fúngico representa una herramienta innovadora y eficaz de lucha contra Brettanomyces. Varios trabajos llevados a cabo en laboratorio mostraban la eficacia del quitosano, y desde 2008, experiencias en condiciones reales de bodega confirman su efectividad en muy diversas condiciones. Todo el conocimiento adquirido a partir de los resultados de estas experiencias han ayudado a los enólogos a refinar sus métodos para monitorizar la efectividad del tratamiento, y han contribuido a comprender el modo de acción del quitosano sobre las células de Brettanomyces.
Origen del quitosano utilizado en enología
El quitosano es una molécula derivada de la quitina. La quitina y el quitosano se encuentran entre los polímeros de origen natural más extendidos en la Tierra, solo superados por la celulosa. La quitina se encuentra especialmente en los exoesqueletos de los crustáceos e insectos, así como en la pared celular de ciertos hongos.
Un derivado desacetilado de quitina, el quitosano, es un copolímero β-1-4 lineal de N-acetil D-glucosamina y D-glucosamina (fig. 1), obtenida por hidrólisis de los grupos acetilo (CH3-CO). Esta operación libera los grupos amino primarios (R-NH2) y confiere una naturaleza «catiónica» al quitosano.
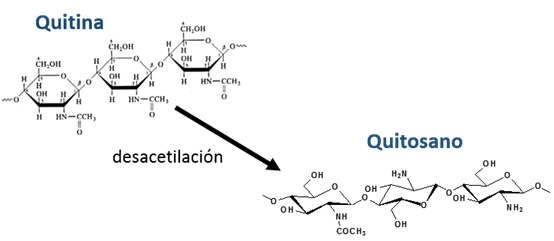
De hecho, no hay solo uno sino varios quitosanos, ya que las variaciones en el grado de desacetilación, el peso molecular y la preparación de las formulaciones (granulometría, en particular) dan como resultado moléculas con propiedades y acciones variadas.
La innovación que llevó a recibir la aprobación para el uso de quitosano en enología es el proceso para obtener quitina de una fuente fúngica no animal, Aspergillus niger. Este proceso, patentado por Kitozyme, proporciona una fuente natural de quitosano que es biodegradable y no alergénica.
Las propiedades antibacterianas y antifúngicas del quitosano han sido ampliamente estudiadas y documentadas y hoy son bien reconocidas. Numerosos estudios demostraban la acción antimicrobiana de este polímero frente a bacterias diversas y patógenos, pero igualmente sobre ciertos hongos de la vid como Botrytis.1 Sin embargo, únicamente en un estudio de Gómez-Rivas publicado en 2004,2 se hacía referencia al interés del quitosano en medios fermentativos y, más particularmente, para la inhibición del crecimiento de Brettanomyces.
Bornet y Teisseidre3 investigaron las propiedades enológicas del quitosano, especialmente en relación con Brettanomyces bruxellensis, primero en el laboratorio y luego en vinos de Languedoc-Rosellón.4 Diez días después del tratamiento con quitosano a una dosis de 4 g/hL, las poblaciones de Brettanomyces en vinos contaminados fueron generalmente no detectadas en medios de cultivo selectivos. Al mismo tiempo, los mismos vinos, sin tratar, a menudo mostraban aumento o mantenimiento de poblaciones contaminantes. Por lo tanto, la efectividad del quitosano, específicamente en la lucha contra Brettanomyces bruxellensis en vino, se demostró claramente.
Modo de acción sobre Brettanomyces
Los estudios llevados a cabo en el 2011 por el INP-ENSIACET de Toulouse dirigidos por Patricia Taillandier,5 tenían como objetivo ampliar el conocimiento sobre el modo de acción del quitosano y el origen de la inhibición del crecimiento de Brettanomyces en el vino.
Se llevaron a cabo experimentaciones sobre medio sintético con el fin de controlar bien la composición (ácido tartárico 3 g/L; glicerina 6 g/L; etanol 13 % v/v; pH 3,7; Brettanomyces 106 células/mL). La acción letal del quitosano fue analizada por citometría de flujo en el tiempo posterior a la introducción del quitosano (T0, T5horas y T24horas) en comparación con una modalidad control que no fue sometida a ningún tratamiento.
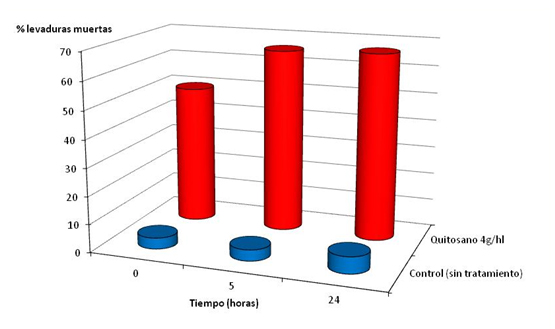
La citometría de flujo permite diferenciar las células muertas y las células vivas. Así como lo demuestra la figura 2, en medio sintético, la acción letal del quitosano frente a Brettanomyces es rápida. A la dosis de 4 g/hL, 5 horas bastan para ver un efecto letal sobre el 60 % de la población de Brettanomyces presente en el medio sintético.
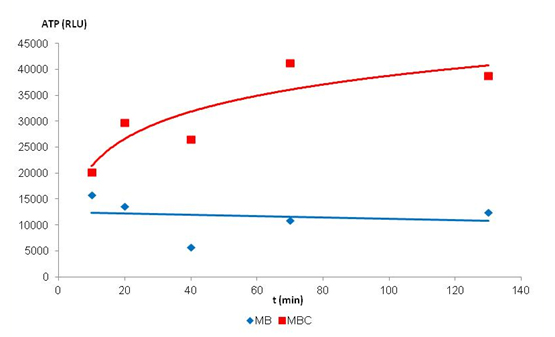
Este estudio permitió también demostrar que el quitosano tenía igualmente un efecto biológico frente a Brettanomyces. En este sentido se realizaron medidas de flujo de ATP intracelular durante las dos horas comparando una modalidad control (ausencia de quitosano en el medio sintético + Brettanomyces 18 x 106 células/mL) y una modalidad tratamiento (presencia de quitosano a la dosis de 10 g/hL en el medio sintético + Brettanomyces 18 x 106 células/mL).
Podemos observar en la figura 3 que la presencia de quitosano genera una liberación del ATP en el medio. Este fenómeno se traduce en una perturbación fuerte de la permeabilidad de la membrana de Brettanomyces muy probablemente correlacionada a la mortalidad de Brettanomyces observada.
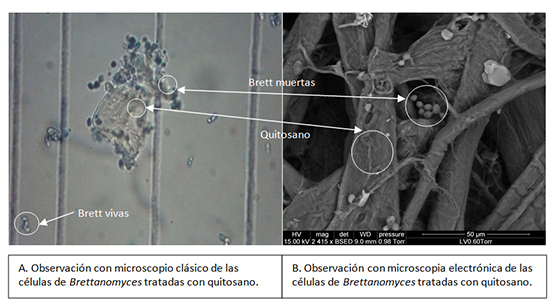
Durante este trabajo, se demostró igualmente el efecto físico que el quitosano tenía frente a las células de Brettanomyces. Como muestran las fotos de observación de microscopia clásica (fig. 4A) y de microscopia electrónica (fig. 4B), el quitosano y Brettanomyces se agregan, gracias muy probablemente, a interacciones de carga, lo que provoca la sedimentación de las células de Brettanomyces. En efecto, al pH en el que se realizaron los estudios, pH del vino, el quitosano está cargado positivamente, mientras que la superficie de la levadura Brettanomyces está cargada negativamente.
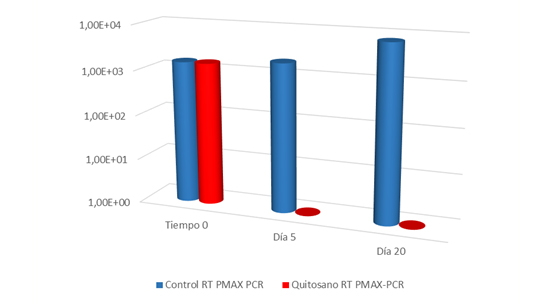
Estudios más recientes, donde se comparaban diferentes técnicas de detección mediante técnicas de biología molecular, han contrastado el efecto letal del quitosano sobre las células de Brettanomyces. A partir de una muestra de vino (procedente de bodega), se realizó el análisis de la población de Brettanomyces por RT-PCR-PMAX (PCR en tiempo real con PMAX según técnica adoptada por Laboratorios Excell Ibérica, 2017).
Esta técnica permite cuantificar de manera exclusiva las células vivas que no han sufrido daño en su estructura celular. PMAX es una tecnología de doble tinte desarrollada por GenIUL. Combinando ambos tintes, se neutralizará el DNA de las células muertas (con membranas dañadas o no dañadas); por lo tanto, solo se detectará DNA de células vivas. Este producto es muy efectivo para eliminar la amplificación por PCR del DNA de células muertas y proporcionar la mejor discriminación entre bacterias vivas y muertas.
Así, a partir de una población inicial de 1,5 x 103 células/mL, se llevó a cabo la aplicación de quitosano a la dosis de 4 g/hL, analizando las células vivas a los 5 y 20 días posteriores al tratamiento. Se puede observar en la figura 5 un efecto letal sobre las células a los 5 días, que se mantiene a los 20 en relación con el vino control utilizado como testigo.
En conclusión, todos estos estudios permitieron demostrar que el quitosano tenía dos efectos complementarios frente a las células de Brettanomyces presentes en los vinos:
-
- Un efecto biológico: Interacción entre el quitosano y la membrana de Brettanomyces que provoca una pérdida de la viabilidad de estas últimas.
- Un efecto físico: Interacción de carga entre el quitosano y la pared de Brettanomyces que provoca la agregación y la sedimentación de Brettanomyces.
Los resultados y perspectivas
En referencia a la aplicación en condiciones de bodega, se ha contrastado la eficacia del tratamiento gracias a las numerosas experiencias en diferentes matrices de vino, variedades y zonas vitivinícolas del mundo. Una parte importante de estos resultados se han obtenido en aplicaciones realizadas en bodegas de diferentes zonas de España.
Algunos de estos resultados se agrupan en la figura 6, en los que se sigue la evolución de las poblaciones de Brettanomyces después de un tratamiento de 10 días de quitosano a la dosis 4 g/hL seguido por un trasiego. Estas medidas se realizaron 10 días después del trasiego y a los 3 meses del trasiego. En estas condiciones industriales en que las recomendaciones de aplicación del quitosano de origen fúngico han sido bien seguidas, la eficacia del tratamiento se demuestra sobre niveles de población que pueden alcanzar niveles superiores a 104 UFC/mL.
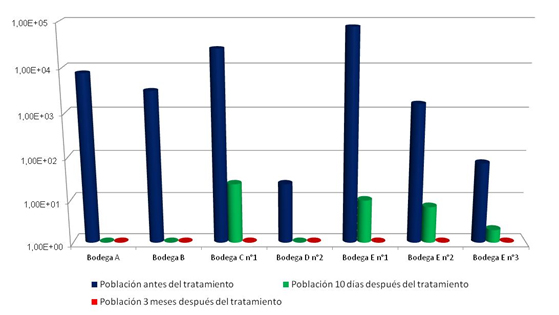
En estas experiencias, se analizaron los niveles de fenoles volátiles en los tres momentos indicados anteriormente (antes de tratamiento, 10 días y tres meses después del mismo). No se observaron aumentos de los niveles de 4-etilfenol y 4-etilguayacol por parte de las células afectadas por el tratamiento, hecho que va en la línea de los datos presentados sobre el efecto letal en un corto espacio de tiempo.
Por otra parte, se realizaron controles analíticos de otros parámetros enológicos, en los que se comprobó la no incidencia de los tratamientos en la acidez del vino, pH, acidez volátil, color o polifenoles totales. En cuanto al análisis sensorial no se perciben cambios desde el punto de vista aromático y la calidad gustativa del vino.
«Retrasar el trasiego podría proteger el vino de una posible recontaminación con Brettanomyces.»
A notar que en el caso del análisis de las poblaciones residuales por RT-PCR, se pusieron en evidencia algunos resultados de falsos positivos a la cuantificación de DNA presente en células muertas o en estado «subletal», si tras el trasiego no se respeta un cierto plazo (por lo menos 20 días).
A partir de la experiencia y conocimientos sobre el modo de acción, se abrieron nuevos horizontes para explorar. Por ejemplo, cuando el vino se lleva a crianza durante un período prolongado, el enólogo puede estar interesado en un tiempo de contacto más prolongado con el quitosano, y retrasar el trasiego más de 10 días después de la incorporación. Las ventajas se duplicarán:
• En lugar de realizar un trasiego innecesario, el enólogo puede aprovechar el trasiego clásico para eliminar el producto.
• Sobre todo, retrasar el trasiego podría proteger el vino de una posible recontaminación con Brettanomyces.
En 2014, Nardi y Sieczkowski6 llevaron a cabo un experimento en Italia para probar estas hipótesis y optimizar la utilización de quitosano. Un vino merlot y un vino sangiovese fueron inoculados con Brettanomyces (103 células/mL) y cada vino se separó en tres partes alícuotas:
• Un control no tratado, que se sometió a bâtonnage una vez por semana.
• Dos alícuotas por vino tratado con quitosano (4 g/hL), sin trasiego; en una de ellas se realizó un bâtonnage una vez por semana, el otro no se sometió a bâtonnage.
Cada vino en el ensayo fue analizado durante seis meses. El SO2 de todos los vinos se reajustó después de 200 días.
Los resultados (fig. 7) parecen mostrar el valor del contacto prolongado con el quitosano mientras tiene lugar la crianza del vino (6 y 9 meses, respectivamente).
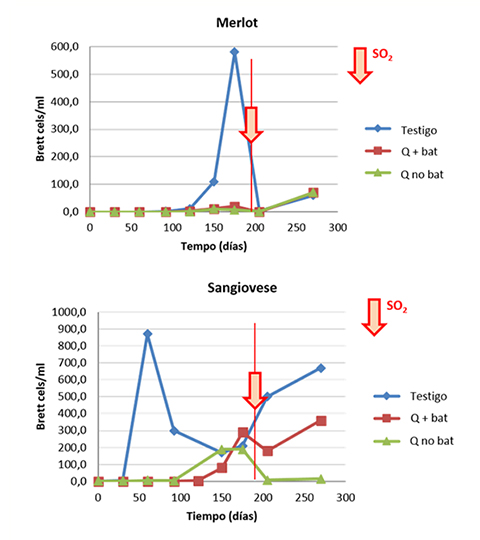
La alternativa sin bâtonnage parece ser más efectiva en el caso del vino sangiovese, aunque no fomente el contacto repetido entre el producto y las células de levadura. Estas pruebas no permitieron llegar a una conclusión clara, pero podemos imaginar dos explicaciones:
• El bâtonnage alentó la regeneración de Brettanomyces al poner las lías en suspensión e incorporar oxígeno, etc.
• El bâtonnage resultó en un sesgo en la estimación de la concentración de Brettanomyces en los vinos, por resuspender y homogeneizar las células.
También se debe destacar el importante papel del SO2, ya que es una herramienta de control que sigue siendo necesaria y actúa en sinergia con la acción del quitosano.
Se están realizando diversas investigaciones adicionales en diferentes condiciones destinadas a completar y refinar estas conclusiones.
Conclusiones
A la luz de las experiencias llevadas a cabo por varios equipos de investigación, así como en laboratorios y bodegas, confirman que el quitosano puro de origen fúngico es una herramienta efectiva en la lucha contra la contaminación por Brettanomyces.
La incorporación homogénea de quitosano en el vino, una garantía de su efectividad, da como resultado la total destrucción de las poblaciones de Brettanomyces o, en ciertos casos, una reducción significativa de las poblaciones contaminantes.
«El quitosano puro de origen fúngico es una herramienta efectiva en la lucha contra la contaminación por Brettanomyces.»
Es importante garantizar un protocolo de control adaptado a estos tratamientos, teniendo en cuenta la existencia de poblaciones subletales y la detección de falsos positivos por ciertos métodos de detección.
Diversas investigaciones han aclarado el modo de acción del quitosano frente a Brettanomyces, al tiempo que destacan la velocidad de su acción, tanto para reducir la población como para prevenir la aparición de fenoles volátiles.
No alergénico, de origen natural y sin impacto negativo en la calidad sensorial del vino, el quitosano de origen fúngico es una herramienta innovadora para evitar la pérdida de calidad generada por Brettanomyces bruxellensis.
Bibliografía
1. Barka EA. Chitosan improves development, and protects Vitis vinifera L. against Botrytis cinera. Plant Cell Reports 2004; 22 (8): 608-14.
2. Gómez-Rivas L, Escudero-Abarca B, Aguilar-Uscanga MG, Hayward-Jones PM, Mendoza P, Ramírez M. Selective antimicrobial action of chitosan against spoilage yeasts in mixed culture fermentations. J Ind Microbiol Biotechnol 2004; 31: 16-22.
3. Bornet A, Teisseidre PL. Élimination des goûts terreux (la géosmine) et des Brettanomyces par l’utilisation d’un biopolymère fongique: le chitosane. OIV Proceedings, 2008.
4. Blateyron-Pic L, Granes D, Sieczkowski N, Bornet A. Chitosane : un nouvel outil pour lutter contre Brettanomyces et préserver les qualités aromatiques des vins. Le IXe symposium international d’oenologie. Bordeaux (France), 2011.
5. Taillandier P, Joannis-Cassan C, Jentzer J-B, Gautier S, Sieczkowski N, Granes D, Brandam C. Effect of a fungal chitosan preparation on Brettanomyces bruxellensis, a wine contaminant. J Applied Microbiol 2014; 118: 123-31.
6. Nardi T, Vagnoli P, Minacci A, Gautier S, Sieczkowski N. Evaluating the impact of a fungal-origin chitosan preparation on Brettanomyces bruxellensis in the context of wine aging. Wine Studies 2014; 3: 4574.
Bibliografía recomendada
. Blateyron-Pic L, Bornet A, Brandam C, Jentzer JB, Granes D, Heras JM, Joannis-Cassan C, Pillet O, Sieczkowski N, Taillandier P. 2012. Le chitosane d’origine fongique: un nouvel outil de choix pour lutter contre Brettanomyces dans les vins. Revue des oenologues 2012; 143: 27-8.
. Chatonnet P. Brettanomyces, mythes et réalités. Revue des oenologues 2012; 144: 42-8.
. Eaton P, Fernandes JC, Pereira E, Pintado ME, Malcata FX. Atomic force microscopy study of the antibacterial effects of chitosanes on Escherichia coli and Staphylococcus aureus. Ultramicroscopy 2008; 108: 1128-34.
. Jentzer JB. Effet anti-Brettanomyces du chitosane en vinification. Dissertation. Toulouse (France), 2011.
. Kong M, Chen XG, Xing K, Park HJ. Antimicrobial properties of chitosan and mode of action: A state of the art review. Int J Food Microbiol 2010; 144: 51-63.
. Kumar MNVR. A review of chitin and chitosan applications. React Funct Polym 2000; 46: 1-27.
. Rabea EI, Badawy MET, Stevens CV, Smagghe G, Steurbaut W. Chitosan as antimicrobial agent: Applications and mode of action. Biomacromolecules 2003; 4: 1457-65.
. Petrova B, Cartwright ZM, Edwards C. Effectiveness of chitosan preparations against Brettanomyces bruxellensis grown in culture media and red wines. J Int Sci Vigne Vin 2016; 50 (1): 49-56.
. Savard T, Beaulieu C, Coucher I, Champagne CP. Antimicrobial action of hydrolyzed chitosanagainst spoilage yeasts and lactic acid bacteria of fermented vegetables. J Food Protect 2002; 65: 828-33.
. Sudarshan NR, Hoover D, Knorr D. Antibacterial action of chitosan. Food Biotechnol 1992; 6: 257-72.
. Zakrzewska A, Boorsma A, Brul S, Hellingwerf KJ, Klis FM. Transcriptional response of Saccharomyces cerevisiae to the plasma membrane-perturbing compound chitosan. Eukaryot Cell 2005; 4: 703-15.
. Zivanovic S, Basurto CC, Chi S, Davidson PM, Weiss J. Molecular weight of chitosan influences antimicrobial activity in oil-in-water emulsions. J Food Prot 2004; 67: 952-59.
. Zuehlke JM, Petrova B, Edwards CG. Advances in the control of wine spoilage by Zygosaccharomyces and Dekkera/Brettanomyces. Ann Rev Food Sci Technol 2013; 4: 4.1-4.22.