Introducción
Brettanomyces sp. (B. bruxellensis, B. anomala) es una levadura alterante, de frágil desarrollo durante las etapas de fermentación del vino, y difícil de detectar en la uva de partida y en el vino terminado. Sin embargo, tiene una fisiología propicia para desenvolverse con comodidad en los largos períodos de envejecimiento en barrica, produciendo en su desarrollo metabolitos que deterioran irremediablemente la calidad del vino. Su deletéreo metabolismo produce etil y vinil fenoles, ácidos orgánicos y acetiltetrahidropiridinas (fig. 1), qué originan una significativa degradación de la calidad sensorial. Además, la expresión de actividad β-glucosidasa libera antocianidinas, deglucosilando los antocianos, y afecta de forma notable a la estabilidad de color. Varias revisiones han tratado en detalle la ecología, fisiología, metabolismo, detección y control de Brettanomyces.1-4

Su morfología es ojival con un diámetro inferior a 2-3 µm y una longitud que puede superar los 10 µm (fig. 1). Esto hace que las yemas más pequeñas tengan facilidad para atravesar membranas de 1 µm y probablemente también de 0,65 y 0,45 µm, lo que dificulta su eliminación del vino. Especialmente con membranas que no afecten la estructura coloidal y el color de los vinos tintos. Presenta en cultivos envejecidos un inicio de pseudomicelio ya que las células hijas quedan unidas a las parentales formando una estructura dendrítica (fig. 1). Brettanomyces es la forma anamorfa que presenta únicamente reproducción asexual por gemación, mientras que Dekkera (D. bruxellensis, D. anomala) es la teleomorfa que presenta reproducción sexual y esporulación.
Se ha descrito que puede utilizar un número elevado de moléculas como fuente de carbono siendo capaz de fermentar y asimilar glucosa y de forma variable puede utilizar sacarosa, maltosa, trealosa, glicerol e incluso etanol.5 El etanol posiblemente sea su fuente principal de carbono cuando se desarrolla en vinos secos durante el envejecimiento en madera. También la celobiosa hidrolizada de la celulosa de la madera puede ser asimilada por Brettanomyces.
Su eliminación de la barrica es un proceso complejo, los profesores Manuel Malfeito y Virgilio Loureiro de la Universidad de Lisboa han llegado a aislar células de Brettanomyces a 8 mm de profundidad en el interior de las duelas, lo que hace difícil erradicar Brett de la madera de la barrica mediante técnicas que no dañen a esta.
La detección de Brett se puede realizar mediante medios selectivos diferenciales que utilizan habitualmente como elemento limitante etanol como fuente de carbono, asociado a veces a pequeñas concentraciones de glucosa para acelerar el crecimiento. Como indicador diferencial se utiliza azul de bromofenol que se decolora a pH bajo debido a la producción de ácido acético por Brettanomyces. También se puede hacer por técnicas moleculares RAPD-PCR o qPCR.
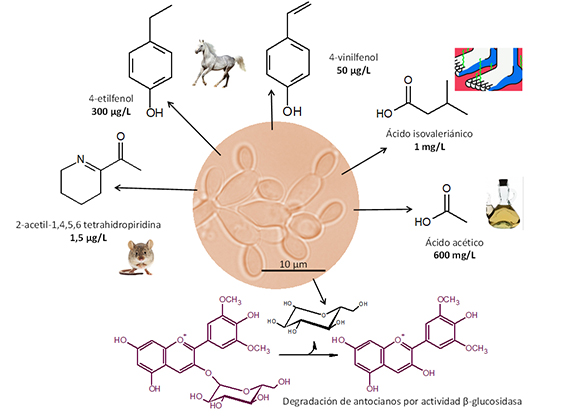
También se puede detectar y monitorizar Brettanomyces siguiendo sus metabolitos fermentativos o de desarrollo como 4-etilfenol o ácidos grasos mediante cromatografía GC-MS. Habitualmente se hace una preparación de muestra por HSME con fibras específicas y después inyección en GC-MS.
Otra forma de monitorizar Brett es mediante el empleo de sensores o nanosensores que analicen en línea la formación de 4-etilfenol. Estos sensores podrían estar en cada barrica y emitir una señal RF que el enólogo recibiera como una alarma en su ordenador o teléfono móvil mediante una aplicación o app. Una monitorización continua de todas las barricas permitiría aplicar medidas terapéuticas eficientes y rápidas cuando se eleve la concentración de etilfenoles u otras moléculas por encima de determinados valores.
Parámetros que favorecen el desarrollo de Brettanomyces/Dekkera y la formación de etilfenoles
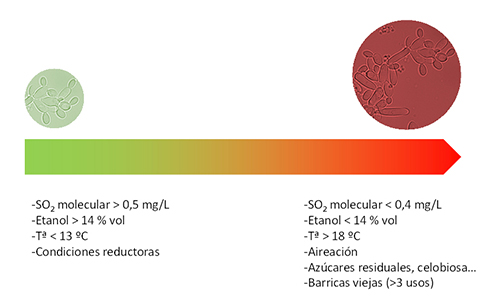
Para un control efectivo se precisan niveles de SO2 molecular superiores a 0,5 mg/L, pero cuando estos bajan a lo largo del envejecimiento en barrica puede producirse su desarrollo (fig. 2). Adicionalmente grados alcohólicos inferiores a 14% vol. y temperaturas próximas a 18 °C favorecen su desarrollo. El oxígeno también favorece su desarrollo por lo que la microoxigenación de la barrica es un factor adicional que considerar.
Como se ha detallado anteriormente, Brettanomyces es responsable de la producción de diferentes metabolitos que producen defectos olfativos en vinos, aunque quizá los más perjudiciales sean los fenoles volátiles. La formación de vinilfenoles y etilfenoles a partir de ácidos hidroxicinámicos de la uva se produce por la secuencia de dos actividades enzimáticas (fig. 3): hidroxicinamato descarboxilasa (HCDC) y vinilfenol reductasa (VPhR). La primera la presentan muchas especies de levaduras incluido Saccharomyces cerevisiae, la segunda es específica de Brettanomyces/Dekkera y de algunas bacterias lácticas.
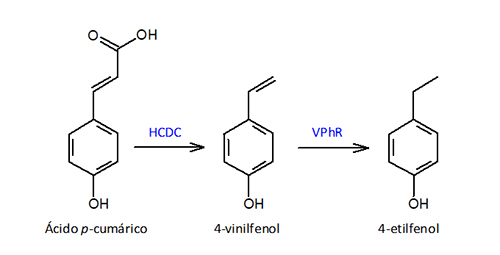
Con respecto a la percepción del 4-etilfenol, dependiendo de la estructura y complejidad del vino, el umbral sensorial de 300 µg/L puede llegar a incluso duplicarse. Del mismo modo, a concentraciones bajas se puede percibir un cierto carácter de complejidad que conforme aumenta de concentración se desplaza hacia defecto olfativo. El 4-vinilfenol también puede considerarse un defecto olfativo a altas concentraciones aunque su perfil fenolado, a disolvente o ahumado, resulta menos conflictivo que el aroma animal del 4-etilfenol. En vinos alterados por Brettanomyces son típicas diferencias de concentraciones de aproximadamente 10 veces entre 4-etilfenol y 4-etilguayacol, aunque este valor promedio puede oscilar en el rango 3:1-20:1.
Herramientas para el control de Brettanomyces/Dekkera en bodega
Para el control de Brettanomyces en bodega se pueden utilizar diferentes técnicas no térmicas que suponen el uso de aditivos antimicrobianos o tecnologías físicas (tabla 1). Se debe considerar siempre que una medida esencial en el control de Brettanomyces es la higiene en bodega y especialmente durante el envejecimiento en madera.
Tradicionalmente los problemas de Brettanomyces se concentran en zonas con parques de barrica envejecidos. La reutilización excesiva de las barricas es una forma de extender las contaminaciones debido a que no existe un tratamiento totalmente efectivo de esterilización de las barricas. La resiliencia de Brettanomyces y los períodos largos favorecen su desarrollo incluso aunque la contaminación inicial sea pequeña. El principal aliado antimicrobiano tradicional del enólogo es el uso del SO2, pero su principal problema es la caída de las concentraciones de SO2 molecular a lo largo del tiempo. Son precisos contenidos superiores a 0,5 mg/L, difíciles de mantener a largo plazo, especialmente en las condiciones oxidativas del envejecimiento en barrica y con vinos de pH elevados.
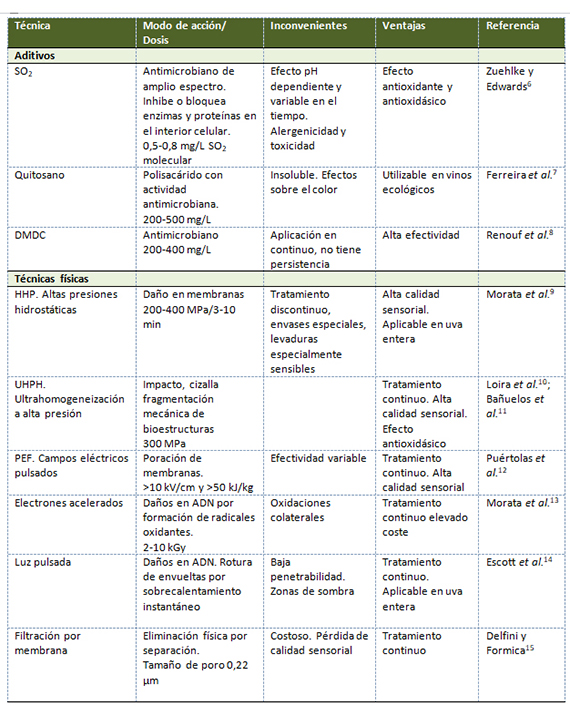
El empleo de técnicas físicas no térmicas es una potente herramienta que facilita el control de Brettanomyces. El recurso tradicional es la filtración amicróbica, el problema es que debido al pequeño tamaño y geometría ojival de las células jóvenes solo la filtración de 0,22 µm garantiza la eliminación, lo que, en vinos tintos, especialmente en aquellos de elevada estructura, puede suponer una pérdida de cuerpo y color. Sin embargo, otras técnicas emergentes no físicas permiten una alta inactivación sin aumentar la temperatura de los vinos y por tanto sin degradar su calidad sensorial; además en algunos casos pueden ser incluso tratamientos continuos. Los tratamientos por presurización hidrostática (HHP) o continua (UHPH) muestran una alta efectividad. También las técnicas de irradiación como la luz pulsada o el UV-C. Estas tecnologías abren perspectivas muy interesantes para el control de Brettanomyces en bodega.
Piranoantocianos vinilfenólicos
Una estrategia protectora muy interesante fundamentada en un proceso natural que implica la formación de pigmentos estables es favorecer la formación de piranoantocianos vinilfenólicos. La formación de estos compuestos en vinos inicialmente se describió como un proceso fisicoquímico por condensación de los ácidos hidroxicinámicos con antocianos de la uva16 (fig. 4). Esta condensación envuelve una secuencia de reacciones que se producen de manera lenta en las condiciones oxidativas del envejecimiento en barrica y se ha indicado que los contenidos de estos piranoantocianos pueden comportarse como marcadores de edad pudiendo relacionarse su contenido con el grado de envejecimiento.16 Estos pigmentos son piranoantocianos estables, poco sensibles a decoloración por SO2, a modificaciones de color por pH y a degradaciones oxidativas, aunque su color es rojo anaranjado,17 con máximos de absorción de 505-510 nm.
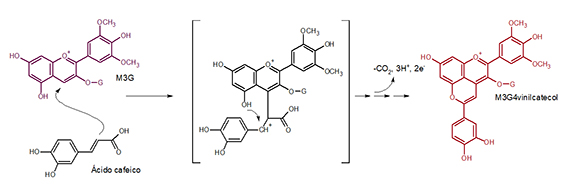
Esta reacción está representada para el ácido cafeico, ya que los vinos estudiados en este trabajo16 procedían de la variedad pinotage rica en este ácido hidroxicinámico, pero es posible para cualquier ácido hidroxicinámico incluido el p-cumárico precursor del 4-vinilfenol y del 4-etilfenol.
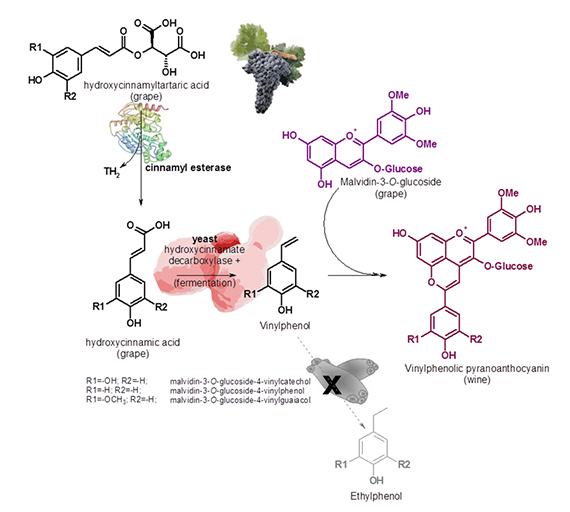
Nuestro equipo propuso una estrategia biotecnológica para eliminar precursores de etilfenoles transformándolos en piranoantocianos vinilfenólicos estables.18 Incluso si se utilizan enzimas esterasas se puede partir de los ésteres tartáricos de ácidos hidroxicinámicos que también son precursores y más abundantes.18 Estos se hidrolizan durante el envejecimiento en madera liberando ácidos hidroxicinámicos.
«Es una ruta enzimático-fermentativa-química que protege los vinos de la formación de etilfenoles y al mismo tiempo mejora la estabilidad de color.»
El proceso consiste en hidrolizar primero los ésteres tartáricos de ácidos hidroxicinámicos enzimáticamente para después durante la fermentación, utilizar una levadura Saccharomyces o no Saccharomyces con actividad hidroxicinamato descarboxilasa, para formar el correspondiente vinilfenol. Este intermediario es una molécula electrófila y altamente reactiva, que espontáneamente condensa con antocianos de la uva, principalmente malvidina, por estar en mayor concentración y formando, por tanto, el piranoantociano vinilfenólico derivado.18 Presenta una alta estabilidad, produciendo color más estable y posteriormente, si el vino en barrica se contamina, Brettanomyces no puede utilizar los vinilfenoles que se han condensado formando pigmentos estables. Es una ruta enzimático-fermentativa-química que protege los vinos de la formación de etilfenoles y al mismo tiempo mejora la estabilidad de color.
Medidas curativas
Finalmente, vinos contaminados con etilfenoles por el metabolismo de Brettanomyces son susceptibles de ser tratados con adsorbentes para eliminar etilfenoles. Diferentes productos, como carbones activos tratados para mejorar su selectividad, reducen de forma significativa los contenidos de etilfenoles. No obstante, también adsorben de forma inespecífica pigmentos y aromas, afectando a la calidad sensorial de los vinos, por lo que la solución pasaría posteriormente por hacer mezclas de estos vinos tratados, con otros no afectados para reducir el efecto en la calidad sensorial.
Recientemente, se ha propuesto como adsorbente el uso de corcho particulado, tratado para aumentar su selectividad.19 Así se consigue un adsorbente mucho más específico, con un menor efecto en la calidad sensorial de los vinos y procedente de un producto natural y muy valorado positivamente en el sector enológico.
Consideraciones finales
El control de Brettanomyces pasa por una aproximación multiparamétrica, en la que la higiene, el uso de madera nueva en el envejecimiento en barrica, el mantenimiento de adecuados niveles de SO2 molecular, y el control y monitorización de las posibles contaminaciones son herramientas útiles para minimizar el problema. La eliminación de precursores mediante biotecnología fermentativa es un potente apoyo que además tiene una cierta influencia en la estabilización del color.
Finalmente, en las medidas curativas para la eliminación de Brettanomyces, las tecnologías emergentes no térmicas suponen una opción cada vez más favorable por su baja repercusión sensorial. En vinos contaminados el uso de adsorbentes cada vez más específicos y de origen natural permite recuperar vinos con difícil solución en el pasado.
Agradecimientos
Ministerio de Ciencia, Innovación y Universidades project: [RTI2018-096626-B-I00]; European Regional Development Fund (ERDF) [FEDER INTERCONECTA EXP-00111498/ITC-20181125]- Proyecto FRESHWINES.
Bibliografía
1. Loureiro V, Malfeito-Ferreira M. Spoilage yeasts in the wine industry. International Journal of Food Microbiology 2003; 86: 23-50.
2. Suárez R, Suárez-Lepe JA, Morata A, Calderón F. The production of ethylphenols in wine by yeasts of the genera Brettanomyces and Dekkera: A review. Food Chemistry 2007; 102: 10-21.
3. Wedral D, Shewfelt R, Frank J. The challenge of Brettanomyces in wine. LWT – Food Science and Technology 2010; 43: 1474-1479.
4. Malfeito-Ferreira M. Two Decades of “Horse Sweat” Taint and Brettanomyces Yeasts in Wine: Where do We Stand Now? Beverages 2018; 4: 32.
5. Smith MT. Dekkera van der Walt. En: The Yeasts – A Taxonomic Study. VI. C. Kurtzman, J.W. Fell, eds. Amsterdam: Elsevier, 1998, p. 176.
6. Zuehlke JM, Edwards CG. Impact of sulfur dioxide and temperature on culturability and viability of Brettanomyces bruxellensisin wine. Journal of Food Protection 2013; 76: 2024-30.
7. Ferreira D, Moreira D, Costa EM, Silva S, Pintado MM, Couto JA. The antimicrobial action of chitosan against the wine spoilage yeast Brettanomyces/Dekkera. Journal of Chitin and Chitosan Science 2013; 1: 1-6.
8. Renouf V, Strehaiano P, Lonvaud-Funel A. Effectiveness of dimethlydicarbonate to prevent Brettanomyces bruxellensis growth in wine. Food Control 2008; 19: 208-16.
9. Morata A, Loira I, Vejarano R, Bañuelos MA, Sanz PD, Otero L, Suárez‐Lepe JA. Grape processing by high hydrostatic pressure: effect on microbial populations, phenol extraction and wine quality. Food and Bioprocess Technology 2015; 8: 277-86.
10. Loira I, Morata A, Bañuelos MA, Puig‐Pujol A, Guamis B, González C, Suárez‐Lepe JA. Use of ultra‐high pressure homogenization processing in winemaking: Control of microbial populations ingrape musts and effects in sensory quality. Innovative Food Science and Emerging Technologies 2018; 50: 50-6.
11. Bañuelos Mª A, Loira I, Guamis B, Escott C, Del Fresno JM, Codina-Torrella I, Quevedo JM, Gervilla R, Rodríguez Chavarría JM, de Lamo S, Ferrer-Gallego R, Álvarez R, González C, Suárez-Lepe JA, Morata A. White wineprocessingby UHPH without SO2. Elimination of microbial populations and effect in oxidative enzymes, colloidal stability and sensory quality. Food Chemistry 2020; 332: 127417.
12. Puértolas E, López N, Condón S, Álvarez I, Raso J. Potential applications of PEF to improve red wine quality. Trends in Food Science and Technologies 2010; 21: 247-55.
13. Morata A, Bañuelos MA, Tesfaye W, Loira I, Palomero F, Benito S, Callejo MJ, Villa A, González MC, Suárez-Lepe JA. Electron beam irradiation of wine grapes: Effect on microbial populations, phenol extraction and wine quality. Food and Bioprocess Technology 2015; 8: 1845-53.
14. Escott C, Vaquero C, del Fresno JM, Bañuelos MA, Loira I, Han SY, Bi Y, Morata A, Suárez-Lepe JA. Pulsed light effect in red grape quality and fermentation. Food and Bioprocess Technology 2017; 10: 1540-7.
15. Delfini C, Formica JV. Microbiological stabilization through filtration. En: Wine Microbiology: Science and Technology. C. Delfini y J.V. Formica, eds. Boca Ratón, Fl: CRC Press, 2001; p. 446.
16. Schwarz M, Wabnitz TC, Winterhalter P. Pathway leading to the formation of anthocyanin−vinylphenol adducts and related pigments in red wines. Journal of Agricultural and Food Chemistry 2003; 51: 3682-7.
17. Morata A, Escott C, Loira I, Del Fresno JM, González C, Suárez-Lepe JA. Influence of Saccharomyces and non-Saccharomyces yeasts in the formation of pyranoanthocyanins and polymeric pigments during red wine making. Molecules 2019; 24: 4490.
18. Morata A, Loira I, Suárez Lepe JA. Influence of yeasts in wine colour, grape and wine biotechnology. IntechOpen, 2016. DOI: 10.5772/65055. Disponible en: https://www.intechopen.com/books/grape-and-wine-biotechnology/influence-of-yeasts-in-wine-colour .
19. da Mota Ribeiro LF, Gil Cosme Martins MF, Ferreira Milheiro Nunes FH. Air depleted and solvent impregnated cork powder as a new natural and sustainable wine fining agent, advances in grape and wine biotechnology. IntechOpen, 2019. DOI: 10.5772/intechopen.85691. Disponible en: https://www.intechopen.com/books/advances-in-grape-and-wine-biotechnology/air-depleted-and-solvent-impregnated-cork-powder-as-a-new-natural-and-sustainable-wine-fining-agent