La transformación del mosto de uva en vino resulta de la actividad secuencial de diversos microorganismos. Las levaduras Saccharomyces cerevisiae, unas de las primeras en colonizar el mosto, degradan los azúcares de la uva y producen etanol y CO2 en un proceso denominado la fermentación alcohólica (FA). En este metabolismo carbonado central se injertan otros metabolismos secundarios que contribuyen a la formación de compuestos de interés organoléptico como los ésteres y alcoholes superiores que hacen del proceso fermentativo una etapa clave en la elaboración de los vinos de la calidad.1 Sobre vinos tintos y en algunos vinos blancos intervienen posteriormente las bacterias lácticas, principalmente la especie Oenococcus oeni, para degradar el ácido-L-málico en ácido-L-láctico con una liberación de CO2: se trata de la fermentación maloláctica (FML). Esta asegura una desacidificación biológica del vino y una evolución favorable de su perfil aromático.2
«Se usan calificativos tan dispares como ‘medicinal’, ‘ahumado’ o ‘animal’ para los olores conferidos por los compuestos causados por la levadura B. bruxellensis.»
Pero no todas las intervenciones microbianas son favorables. De hecho, algunas pueden ser muy perjudiciales para la calidad del vino. Entre estas alteraciones microbianas, la producción de los fenoles volátiles (4-etilfenol y 4-etilguayacol) por la levadura Brettanomyces bruxellensis3 está considerada como una de las más problemáticas. Calificativos tan dispares como «medicinal», «ahumado» o «animal» se emplean para calificar los olores conferidos por estos compuestos,4 provocando una pérdida del carácter afrutado y perjudicando considerablemente la calidad y la tipicidad del vino.
Originaria de la uva,5 B. bruxellensis es una especie especialmente bien adaptada a las condiciones del vino. Su tolerancia, tanto a la presencia de oxígeno como a su ausencia, su crecimiento óptimo a los pH enológicos y sus reducidas exigencias nutricionales, le hacen un incómodo compañero de viaje en la elaboración de un vino, convirtiéndole en un importante competidor para el desarrollo de los procesos fermentativos. Esta acción competitiva es mayor cuando el grado probable es elevado, bien porque la presencia de Brettanomyces sobre este tipo de materia prima es inicialmente más elevada, bien porque Brettanomyces tolera mejor las cantidades elevadas de alcohol que S. cerevisae, tomando ventaja cuando la actividad de esta última declina.
En este artículo se proyectan acciones preventivas y correctivas dirigidas a un control de la población de B. bruxellensis durante el proceso de elaboración de un vino, desde la entrada de uva hasta los procesos de conservación previos al embotellado.
EN FERMENTACIÓN ALCOHÓLICA
Colonización del nicho ecológico
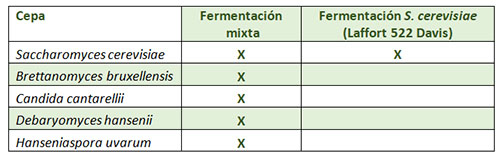
Observemos el siguiente experimento. Se desarrolló una fermentación a escala de laboratorio exclusivamente con S. cerevisae (cepa 522 Davis, Laffort) y la misma, pero a través de una contaminación cruzada con distintas especias de levaduras no Saccharomyces, entre ellas Brettanomyces (tabla 1).
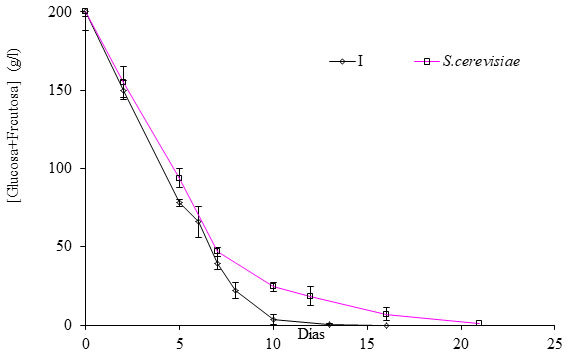
Si atendemos al proceso fermentativo (fig. 1) desarrollado con tales inóculos, observamos que la velocidad de la fermentación del cultivo mixto y de S. cerevisiae puro prácticamente fueron similares hasta el día 7. A partir de ahí, la velocidad de consumo de los azúcares fue mayor para el cultivo mixto 1, indicando que las cepas no Sacharomyces intervinieron para finalizar la fermentación alcohólica. Además, a partir del día 4 de la fermentación alcohólica, la única cepa no Saccharomyces presente en el cultivo mixto fue B. bruxellensis.6 El resto de las especies no Saccharomyces apenas superó el 5% de la población total durante esos primeros 4 días de la fermentación alcohólica (datos no mostrados).
Si nos fijamos únicamente en la dinámica de poblaciones del cultivo mixto I (fig. 2) para S. cerevisae y B. bruxellensis, observamos que Brettanomyces comienza a crecer desde el día 1, y que alcanza al equilibrio en torno a los 12 días. Desde ahí hasta el día 25, prácticamente se desarrollan en paralelo, siendo desde esta fecha Brettanomyces la cepa predominante (fig. 2).
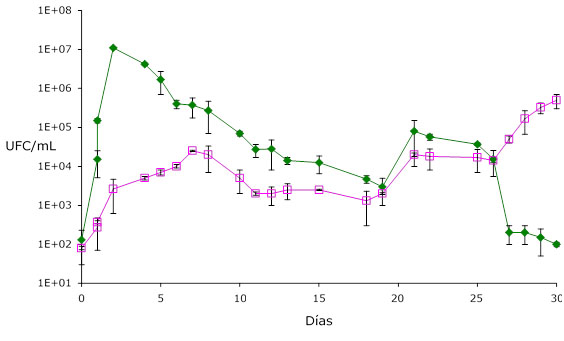
En este experimento se observa claramente que en una situación de contaminación cruzada, en situación de alta presión por parte de Brettanomyces en uva, son los vacíos ecológicos vinculados a una caída de actividad celular de S. cerevisae durante la fermentación alcohólica, cuando Brettanomyces, hongo oportunista, consigue imponer su metabolismo y crecer en ausencia de agentes que impidan su desarrollo. Técnicas enológicas destinadas a rellenar ese vacío microbiológico reducirán notablemente su crecimiento.
EN FERMENTACIÓN MALOLÁCTICA
Evitar huecos ecológicos entre procesos
Al final de una FA, la población de S. cerevisiae –hasta ahora mayoritaria– disminuye y deja libre el nicho ecológico que ahora se disputarán B. bruxellensis y O. oeni. En esta rivalidad, la especie O. oeni lleva ventaja ya que dispone de un sustrato preferencial: el ácido-L-málico. Esto le permite multiplicarse y cuando su población alcanza 106 UFC/mL, se inicia la degradación del ácido-L-málico.
En el marco de una FML autóctona, el tiempo de latencia entre el final de la FA y el inicio de la FML depende principalmente de la población residual de O. oeni al final de la FA. Cuanto más baja es la población residual, mayor es el tiempo de crecimiento para alcanzar el umbral de 106 UFC/mL. En vinos con pH bajos y con elevada concentración de etanol, la población residual inicial tiende a ser muy baja (por debajo de 102 UFC/mL) y es durante este período de latencia entre las dos fermentaciones, cuando el ecosistema microbiológico del vino está vacante, convirtiéndose en una fase de inestabilidad microbiológica extremadamente favorable a la multiplicación de B. bruxellensis.
¿Qué tres situaciones nos podemos encontrar entre al inicio de una FML?
-
- Misma población: FML autóctonas «clásicas». Cuando tenemos poblaciones a niveles idénticos (103 UFC/mL), el paralelismo entre el crecimiento de O. oeni y el de B. bruxellensis es notable y sugiere interacciones entre las dos especies y ningún control competitivo sobre el nicho ecológico.
-
- Población de O. oeni superior a 106 UFC/mL: situación tecnológica consistente en una siembra activa de inóculo de bacteria maloláctica seleccionada. Cuando se siembra una bacteria maloláctica, la población de O. oeni aumenta de manera importante y la cinética de FML es mucho más rápida, manteniéndose B. bruxellensis en niveles bajos de población. La población no aumenta hasta que termina la FML y la población de O. oeni decae.
-
- Población de B. bruxellensis mayoritaria, superior a 106 UFC/mL: el crecimiento de B. bruxellensis predomina hasta que la población de O. oeni alcanza 106 UFC/mL, momento en que declina. Cuando finaliza la FML y la población de O. oeni inicia la fase de declive, B. bruxellensis se multiplica de nuevo.
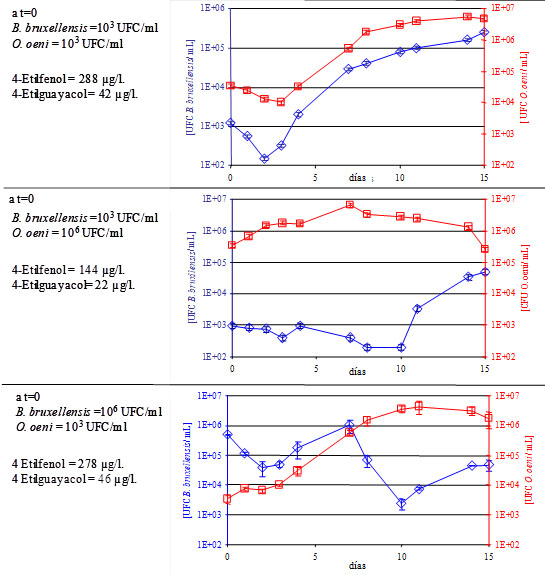
Estos resultados confirman que el desarrollo de O. oeni autóctona durante la FML favorece el crecimiento de B. bruxellensis dado que, durante un período, ambas especies compiten por colonizar el nicho y aunque Oenococcus finaliza su función, Brettanomyces crece y se desarrolla durante el proceso maloláctico.7
Durante esta situación, la producción de fenoles volátiles, en los ensayos realizados, los porcentajes más bajos de estas moléculas indeseables se apreciaron en la partida donde la población de O. oeni era inicialmente la más elevada, lo que indica que la correcta gestión del nicho ecológico conlleva un mejor control de la población de Brettanomyces y una menor producción de fenoles volátiles indeseables.
¿Es importante una fermentación maloláctica rápida para la gestión de B. bruxellensis? Obviamente, sí. Se ha observado una relación directa entre el número de días necesario para el desarrollo de una fermentación maloláctica y la población total de Brettanomyces observadas en el mismo (fig. 4).
Ello nos lleva a concluir que cualquier proceso que limite o reduzca el tiempo de finalización de la fermentación maloláctica
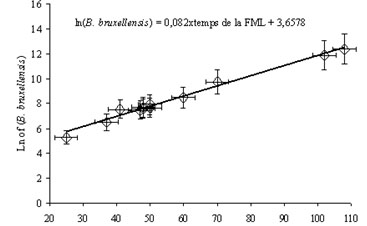
limitará la presencia de Bretanomyces y, por tanto, la formación de los tan temidos etilfenol (EF) y etilguayacol (EG).
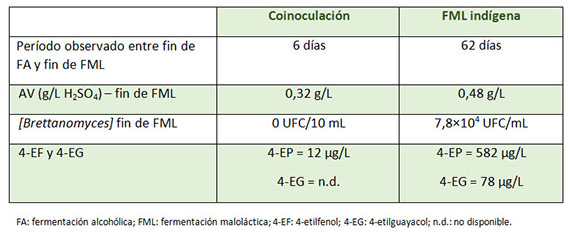
Un proceso que conlleva a reducir los tiempos y por tanto a la gestión de Brettanomyces es la coinoculación Saccharomyces-Oenococcus. Los beneficios de esta técnica como complemento tecnológico dirigidos a cerrar espacios a la entrada de oportunistas microbiológicos es el objetivo de esta operación implantada en bodega ya desde hace varios años. Su base tecnológica consiste en colonizar desde un primer momento el nicho ecológico, rellenando el hueco microbiológico con las dos especies fermentativas más importantes del proceso enológico, S. cerevisae y O. oeni.
Cuando la densidad del mosto ha caído unos 10 puntos y S. cerevisae se encuentra ya consumiendo azúcares, es cuando tecnológicamente se puede realizar la siembra con O. oeni. Este proceso, denominado coinoculacion temprana, es interesante en vinos con pH ligeramente superior a pH 3,3. En condiciones de pH inferiores, la cantidad inicial de SO2 molecular con efecto inhibidor sobre los microorganismos (bastante superior sobre las bacterias) es más importante.
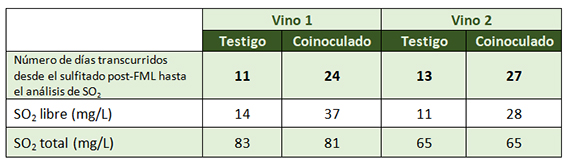
Durante el curso de la fermentación alcohólica, sobre todo en su fase inicial, la actividad fermentativa de las levaduras provoca un ligero descenso del pH,8 dejando en situación aún más restrictiva la viabilidad de O. oeni. Para estos vinos, puede ser mucho más interesante una coinoculacion tardía, en la que la siembra de la bacteria O. oeni se realiza sobre en densidad 1010 y el pH del medio fermentativo ya ha aumentado. En ambos casos provocamos que la FA y FML se vinculen en el tiempo cerrando el espacio para el desarrollo de microorganismo indeseables, entre ellos Brettanomyces, y acortando con ello el proceso maloláctico (tabla 2).
EN CONSERVACIÓN
Empleo de agentes que favorezcan la limpidez
Cualquier proceso que reduzca la presencia de lías o su compactación tras los procesos fermentativos y aumente los fenómenos naturales de clarificación fomentará la caída de las células de Brettanomyces en suspensión. La disminución de la viscosidad del vino y la eliminación del soporte físico que la turbidez pueda ejercer sobre esta población incrementarán la velocidad de sedimentación, sobre todo si se emplean enzimas beta-glucanásicas que corten los sustratos coloidales y favorezcan su precipitación (tabla 3).
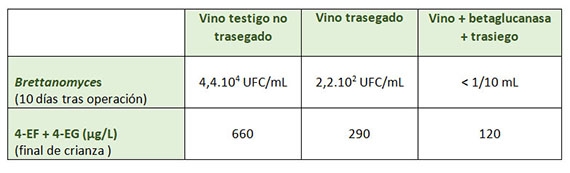
Este proceso de precipitación espontánea podría adelantarse y/o incrementarse si forzamos el efecto de clarificación con el uso de agentes clarificantes que aglomeren las células de B. bruxellensis. Ensayos realizados sobre vinos franceses mostraron la eficacia de la acción del empleo de agentes clarificantes proteicos sobre esta microbiología indeseable (fig. 5).
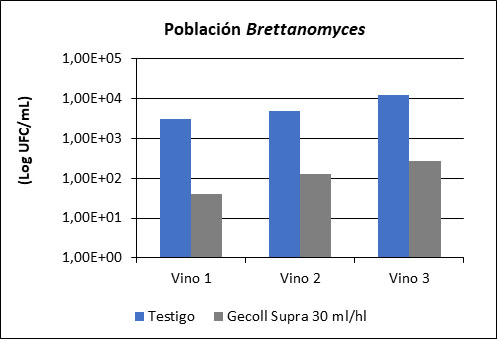
EN CONSERVACIÓN
Anhídrido sulfuroso
El anhídrido sulfuroso es el principal mecanismo de defensa contra la proliferación de Brettanomyces y del resto de la microbiología no amiga, ejerciendo no solo una acción microbiológica, sino también antioxidante como captador de oxígeno importante para la conservación del vino. El contenido de dióxido de azufre molecular activo es el único que tiene propiedades antisépticas y depende principalmente del contenido de dióxido de azufre libre y del pH. Una concentración de dióxido de azufre activo molecular de 0,4-0,5 mg/L tiende a ser suficiente para inhibir la proliferación, aunque no para impedirla completamente. ¿Por qué?
Porque el sulfuroso no siempre es suficiente. Dependiendo de la población, la temperatura o el grado alcohólico pueden ser necesarias cantidades mayores. Además, investigaciones actuales han puesto de manifiesto la resistencia hacia el sulfuroso de determinadas especies del género Brettanomyces.9 Durante estos estudios se caracterizaron varios cientos de estas cepas por análisis genético de microsatélites (zonas repetidas del genoma) y como resultado se obtuvo que un 40% de las cepas analizadas eran resistentes a los sulfitos en la habitual concentración de 0,4 mg/L de SO2 molecular. Todas las cepas que son resistentes a los sulfitos tienen la particularidad de tener un patrón genético de tipo triploide para algunas secciones de su secuencia genética.
En vinos con alta carga de B. bruxellensis (fig. 6) ya se observó que correcciones de sulfuroso elevadas (30 o 60 mg/L) para un pH bajo disminuían la carga microbiológica de Brettanomyces rápidamente. Tras 2 meses de conservación, la población derivaba hacia una mayor resistencia al sulfuroso mostrando un crecimiento paulatino de la población en el tiempo.10
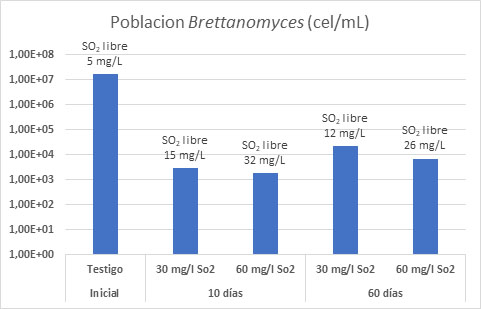
Una primera vía de acción novedosa es poder trabajar sobre ese sulfuroso libre, es decir, ayudar con procesos que deriven en un aumento de ese sulfuroso libre para una misma concentración de sulfuroso total. El acetaldehído es una de las moléculas que más fácilmente se combina con el sulfuroso de un vino y por tanto la que más podría alterar ese sulfuroso libre. Las especies más productoras de acetaldehído son Pichia y Hansenioaspora, aunque S. cerivisae también lo produce, por lo que su control durante la FA es fundamental.
Este acetaldehído siempre se encuentra en niveles cercanos a 50 mg/L en los vinos y su fluctuación dependerá tanto de su producción por parte de las levaduras, oxidaciones parciales por parte de etanol en contacto con el oxígeno, como por su consumo tanto por las reacciones de polimerización en tintos como por las bacterias lácticas. Esta última es otra de las vías para conseguir niveles bajos de combinación de sulfuroso y por tanto un aumento de su concentración molecular para un mismo pH.11
Las bacterias lácticas consumen este acetaldehído, y en situaciones de coinoculación (anteriormente citadas), además de evitar los vacíos ecológicos, reducen la acumulación de parte del acetaldehído debido a un equilibrio entre lo que produce Saccharomyces y lo que consume Oenococcus, limitando su combinación, manteniendo un SO2 libre –y, por tanto, SO2 molecular– superior durante un mayor período (tabla 4).
EN CONSERVACIÓN
Empleo de quitosano fúngico
Fue ante la falta de soluciones plenamente satisfactorias cuando la Organización Mundial de la Viña y el Vino (OIV) aprobó el empleo de quitosano de origen exclusivamente fúngico como una nueva herramienta enológica para el control de Brettanomyces. El quitosano, sin propiedades alergénicas conocidas y con una estructura química y molecular similar a la quitina, puede insertarse en la pared celular del hongo y alterar su estructura. Este «engaño» en la reconstrucción de la estructura de la membrana de Brettanomyces genera una perturbación de la permeabilidad de su membrana, que afecta a su viabilidad celular, y por tanto provocando su muerte.
Su tratamiento sobre vinos de quitosano fúngico puro se ha mostrado eficaz al disminuir la población de Brettanomyces, aunque dependiendo de su población y resistencia no siempre ejerce una acción total sobre el vino.10 Este hecho podría estar vinculado a que Brettanomyces necesita activamente cierta actividad metabólica en el consumo del quitosano y ante su ausencia (células en estado vegetativo o ausentes de metabolismo) tan solo una acción iniciadora pude provocar su activación. En experimentos conjuntos con enzimas beta-glucanásicas que actúen sobre la membrana de Brettanomyces se pudo eliminar totalmente su presencia y mantener su ausencia en el tiempo, probablemente vinculado a la mejora coloidal y por tanto a una mejor acción clarificante (fig. 7).
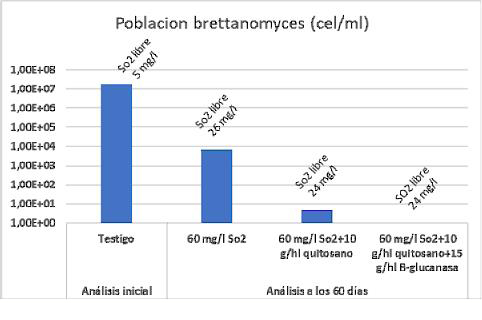
EN CONSERVACIÓN
Madera
Curiosamente a lo que se tiene pensado, si la contaminación proviene originalmente del vino que se va a conservar sobre madera es mucho más factible observar un crecimiento indeseado de Brettanomyces sobre barrica nueva que sobre barrica vieja. Este hecho se justifica por el hecho de que sobre barrica nueva la transferencia de oxígeno es mucho mayor que sobre madera vieja, creciendo a un ritmo mucho más alto que en una barrica vieja (fig. 8). Por ello, la necesidad de verificar la ausencia de contaminación inicial sobre el vino a conservar en barrica es fundamental.
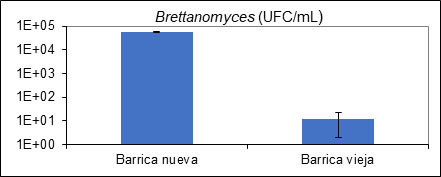
EN CONSERVACIÓN
Filtración
Los procesos de filtración sobre placas, tierras o tangencial son una de las últimas vías para el control de la población ya no solo de Brettanomyces sino de la población contaminante presente y aunque cualquier proceso de filtración disminuye la población de Brettanomyces presente, tan solo a través de filtraciones inferiores a 1 µm es posible una eliminación total de la población de Brettanomyces, mientras que por filtraciones con micrajes superiores tan solo conllevan una reducción temporal de la contaminación12,13 (fig. 9).
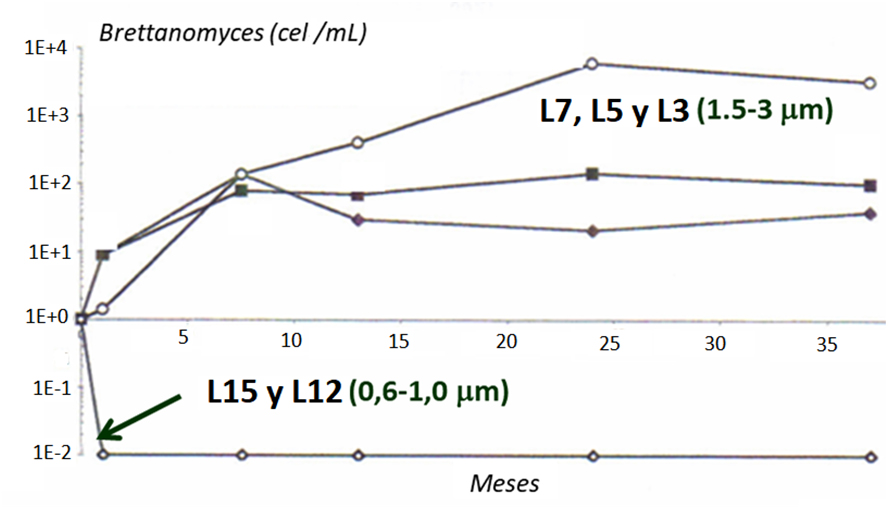
Conclusiones
B. bruxellensis naturalmente perteneciente al amplio elenco de microorganismos enológicos está particularmente adaptada a situaciones vínicas de alta concentración de alcohol, situaciones de anaerobiosis o aerobiosis y bajas concentraciones de nitrógeno. Estos hechos provocan que su ausencia total durante el proceso de elaboración de un vino sea sumamente irreal.
Mecanismos de control como la ocupación de los vacíos ecológicos por S. cerevisae o O. oeni se vuelven primordiales para evitar que esta especie oportunista colonice el nicho.
Agentes que provoquen su eliminación, bien por efectos de clarificación, inhibición o filtración, proporcionan las herramientas necesarias para su control y gestión durante todo el proceso de elaboración de un vino.
Bibliografía
1. Darriet P, Barbe C, Lavigne-Cruège V, Pineau B, Pons A, Sarrazin E, et al. Caractérisation et développement de la typicité aromatique des vins de Bordeaux. 8e Journée Technique du CIVB, 2007, p. 29-37.
2. De Revel G, Martin N, Pripis-Nicolau L, Lonvaud-Funel A, Bertrand A. Contribution to the knowledge of malolactic fermentation influence in wine aroma. Journal of Agriculture and Food Chemistry 1999; 47: 4003-8.
3. Suárez R, Suárez-Lepe JA, Morata A, Calderón F. The production of ethylphenols in wine by yeast of the genera Brettanomyces and Dekkera: a review. Food Chemistry 2007; 102: 10-21.
4. Chatonnet P, Dubourdieu D, Boidron JN. Le caractère phénolé des vins rouges: caractérisation, origine et moyens de lutte. Revue Française d’Œnolologie 1992; 138: 21-4.
5. Renouf V, Lonvaud-Funel A. Development of an enrichment medium to detect Dekkera/ Brettanomyces bruxellensis, spoilage wine yeast, on the surface of grape berries. Microbiological Research 2007; 161: 154-67.
6. Renouf V, Falcou M, Miot-Sertier C, Perello MC, De Revel G, Lonvaud-Funel A. Interactions between Brettanomyces bruxellensis and other yeasts species during the initial stages of winemaking. J Appl Microbiol 2006; 100: 1208-19.
7. Renouf V, Puente V, Murat ML. Biorregulación de Brettanomyces bruxellensis en vinos: gestión del nicho ecológico por especies vínicas. Enoviticultura 2010; 7: 10-5.
8. Akin H. Evolution du pH pendant la fermentation alcoolique de moûts de raisins: modélisation et interprétation métabolique. Tesis doctoral. Institut National Polytechnique de Toulouse, 2008.
9. Renouf V, Etourneau L, Nicolato T, Zaldívar E, Palacios A. Detección y cuantificación de cepas Brettanomyces bruxellensis resistentes al sulfuroso. La Semana Vitivinícola 2019; 3557: 2107-9.
10. Puente V, Soto F, Palacios A. Brettanomyces y SO2. ¿Suficiente para controlar su crecimiento? La Semana Vitivinícola 2015; 3452: 1382-5.
11. Puente V, Hernando J, Martos A, Nieto J, Tobes A, Renouf V. Coinoculación de Saccharomyces cerevisiae-Oenococcus oeni. La semana Vitivinícola 2013; 3408: 1542-5.
12. Renouf V, Perello MC, De Revel G, Lonvaud-Funel A. Microbiology of bottled wines: impacts of the filtration. Am J Enol Vitic 2007; 58: 379-80.
13. Renouf V. Description et caractérisation de la diversité microbienne durant l’élaboration du vin: interactions et équilibres. Relation avec la qualité du vin. Institut National Polytechnique de Toulouse, 2006.