Introducción
Las levaduras pertenecientes al género Brettanomyces y su forma esporulada Dekkera pueden ser una fuente de graves problemas para el vino. De hecho, para algunos incluso el carácter más ligero hace que el vino sea inaceptable, para otros, su presencia se considera una parte integral que puede aportar complejidad. Más allá de las pasiones del profesional enólogo con respecto a estas levaduras, es importante señalar que siguen siendo contaminantes microbiológicos del vino y, por lo tanto, es necesario saber cuánto y cómo las prácticas enológicas pueden afectar a su desarrollo, cuáles son los medios o procedimientos a utilizar para detectar su presencia y cómo prevenir su crecimiento en bodega.
La convivencia del bodeguero con Brettanomyces se hace notar al percibir cambios de expresión sensorial en el vino,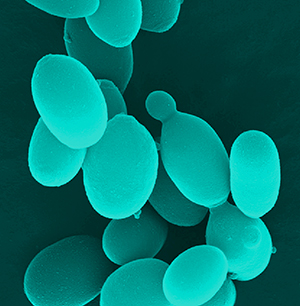 lo que además debería estar respaldado realizando pruebas analíticas y de control de calidad rutinarias en el laboratorio. Las células vegetativas varían de esféricas a globulares, elípticas o cilíndricas, formando también pseudomicelios; a menudo aparecen ojivales, en forma de barquita de remos o sandalia. Se trata de un organizamos unicelular que se reproduce por gemación a 45°.
lo que además debería estar respaldado realizando pruebas analíticas y de control de calidad rutinarias en el laboratorio. Las células vegetativas varían de esféricas a globulares, elípticas o cilíndricas, formando también pseudomicelios; a menudo aparecen ojivales, en forma de barquita de remos o sandalia. Se trata de un organizamos unicelular que se reproduce por gemación a 45°.
El desarrollo de las células de Brettanomyces spp. causa una serie de problemas cualitativos en el vino, como la presencia de turbidez, la producción excesiva de ácido acético, lo que hace aumentar la acidez volátil, aparición del olor a manzana o a sidra y el defecto cada vez más conocido llamado gusto a ratón. Los compuestos químicos responsables de cambiar el aroma del vino son los etilfenoles (2-etilfenol y 2-etilgüaiacol), que se producen mediante descarboxilación y posterior reducción de los ácidos hidroxicinámicos (ácido p-cumárico y p-ferúlico) mediante los enzimas descarboxilasas y reductasas correspondientes.
Más allá de una cierta concentración (umbral sensorial de preferencia), la presencia del 4-etilguayacol puede dar un carácter fuertemente picante, especiado, de clavo, ahumado, mientras que 4-etilfenol aporta un carácter descrito como medicinal, fenólico, lana húmeda, animal, establo. También contribuyen de forma negativa los ácidos grasos volátiles del tipo isovalérico y la 2-acetil-1,4,5,6-tetradropiridina junto a la 2-acetil-3,4,5,6 tetrahidropiridina; estas sustancias se originan a partir de la lisina y el etanol y son las responsables, según los investigadores australianos que lo estudiaron, del gusto a ratón cuando la actividad salivar desacetila las moléculas, volviéndose volátil y por lo tanto perceptible vía retronasal.
Estas levaduras también están equipadas con una fuerte actividad esterásica, pudiendo destruir el carácter afrutado del vino. También la producción de ácidos grasos contribuye a este fenómeno degenerativo, como los ácidos isovalérico, isobutírico y 2-metilbutírico, produciendo aromas lácticos de queso rancio. Durante su desarrollo estas levaduras pueden también oxidar el etanol y producir acetato de etilo, compuesto responsable del carácter de disolvente o acetona.
El hábitat más frecuente de Brettanomyces es el fermentativo propio de bodegas elaboradoras de vino, y no se encuentra tanto en la viña, tal vez debido a sus altas necesidades nutricionales o baja competitividad en este medio frente a otros microorganismos que se encuentran mejor adaptados o en superioridad numérica o que son de crecimiento más rápido. Sin embargo, una vez que llega a bodega, Brettanomyces spp. comienza a colonizar áreas de difícil limpieza y desinfección, como las barricas, por ejemplo. Equipos tales como remolques, mangueras, bombas, toma muestras, remontadores que se utilizan recurrentemente, pero no de forma programada, pueden convertirse en puntos de infección difíciles de controlar.
Otras fuentes importantes del reservorio de Brettanomyces spp. están representadas por las tolvas de recepción de uva, donde abundan los insectos (Drosophila melanogaster) y las abejas, que circulan en la bodega durante la temporada de la vendimia transportando gérmenes contaminantes.
«El nicho preferido de Brettanomyces spp. son los contenedores de madera, pero también equipos como remolques, mangueras, bombas, toma muestras, remontadores, etc.»
Sin embargo, el nicho preferido de Brettanomyces spp. siguen siendo los contenedores de madera: lo que no es tan sorprendente teniendo en cuenta la dificultad para desinfectarlos, además de contener celobiosa generada durante la fase del tostado del interior de la barrica, siendo capaz Brettanomyces de desdoblarla mediante la actividad β-glucosidasa, proporcionando la glucosa necesaria para su propio crecimiento. Las barricas nuevas contienen mayores cantidades de esta sustancia que las usadas y, por lo tanto, pueden promover potencialmente el desarrollo de una población importante de estas levaduras. Por otra parte, la superficie interior de las barricas presenta una cierta porosidad e irregularidades en su estructura, constituyen por ello un nicho preferente en el que las levaduras pueden anidar y refugiarse, absorbiendo nutrientes del medio y protegiéndose de la acción de agentes antimicrobianos, como el SO2. Además, las lías y otras precipitaciones de diversa naturaleza pueden hacer que estos microorganismos estén aún más protegidos en este medio.
Dado que Brettanomyces se caracteriza por un crecimiento lento sin la producción de filmes o velos superficiales ni de CO2, su presencia en el vino puede pasar desapercibida, hasta que aparece la alteración sensorial; por lo tanto, es esencial una higiene y desinfección cuidadosa de la bodega y sus equipos para inhibir el desarrollo de estas levaduras contaminantes, además de realizar continuos análisis microbiológicos para detectar su presencia y a nivel químico de los etilfenoles para medir el daño sensorial producido.
Control preventivo contra Brettanomyces
La forma de anticiparse es trabajar desde el viñedo. El factor agronómico influye en gran medida en el riesgo de contaminaciones embarazosas. No porque la fuente de inoculación se encuentra en las uvas, sino debido a que la composición de la uva influye significativamente en la sensibilidad del vino en el desarrollo de Brettanomyces. De hecho, el desequilibrio en la nutrición mineral de la vid, incluyendo el exceso de potasio y los altos pH, conducen inevitablemente a un aumento del pH de los mostos y vinos. En algunos casos, si la acidez no se corrige a tiempo, será imposible utilizar el anhídrido sulfuroso para inhibir el crecimiento de Brettanomyces. Por el contrario, la falta de fertilización con nitrógeno, por ejemplo, la excesiva competencia (mal control de malas hierbas) o el estrés hídrico excesivo (baja reserva en agua del suelo o riego mal manejado) pueden producir uvas difíciles de fermentar. Sin suplementos correctivos en bodega, las uvas experimentarán una fermentación lenta o encontraremos situaciones de fermentaciones incompletas, ideales para promover el desarrollo de Brettanomyces a corto o medio plazo. Por lo tanto, no puede haber expresión del terroir naturalmente en estos casos donde se favorece el desarrollo de este germen. Es responsabilidad del enólogo, y del bodeguero en especial, corregir o prevenir estas situaciones para así evitar los fenómenos de desequilibrios negativos posteriormente en el vino.
Uso correcto del sulfuroso
El dióxido de azufre es el único antiséptico autorizado en el vino, pero Brettanomyes/Dekkera es relativamente resistente a este antiséptico. El contenido de dióxido de azufre molecular activo, el único que tiene propiedades antisépticas, depende principalmente del contenido de dióxido de azufre libre y del pH (0,2 unidades de pH equivalen a +50% SO2 activo); en segundo lugar, de la temperatura (1 °C = 7% de SO2 activo) y del contenido en etanol del vino (1% vol. = 5% SO2 activo). Una concentración de dióxido de azufre activo molecular de 0,5 mg/L es suficiente para inhibir la proliferación sin impedirla completamente. De 0,7 a 0,8 mg/L, el contenido se convierte en letal si la temperatura es suficientemente alta. Así, si un nivel de 25 mg/L es suficiente para controlar el desarrollo de Brettanomyces a pH 3,60, se necesitará al menos 35 mg/L a un pH de 3,75 y aproximadamente 60 mg/L a pH 3,90. Por tanto, es claro que el uso de sulfuroso está gravemente limitado por la acidez real de vino, este parámetro representa un elemento clave de la resistencia natural del vino frente a la contaminación por este tipo de germen. El sulfitado del vino criado en barricas nuevas debe ser aún más cuidadoso, ya que la estabilidad de dióxido de azufre en estas condiciones es mucho más aleatoria. El tapón en posición lateral durante las crianzas prolongadas, la ausencia de relleno como pretexto de utilizar tapones de silicona más estancos, la reducción de la dosis de dióxido de azufre o la ausencia de trasiegos regulares para limitar el trabajo en la bodega, son todos factores que han causado una explosión de contaminaciones en bodega en los últimos años. Por último, siempre hay que considerar el sulfitado del vino como una herramienta de lucha preventiva y no como un tratamiento curativo.
Quemado de mechas de azufre en las barricas
El conocido mechado de las barricas después de su limpieza mediante combustión de azufre es una práctica cada vez menos empleada a causa de su incomodidad, e incluso recientemente puesta en duda en términos legales y sanitarios. Sin embargo, la acción del dióxido de azufre gaseoso es particularmente interesante para la desinfección de la superficie y de los primeros escasos milímetros de las duelas de las barricas. La práctica del mechado ha demostrado su eficacia en la prevención de la contaminación por Brettanomyces cuando otros medios de desinfección (especialmente el vapor) no están disponibles en bodega. Su sustitución por técnicas alternativas, tales como lavado con agua ozonizada, está en estudio para verificar si puede o no producir exactamente el mismo resultado debido a la acción, en parte superficial, del componente activo. Entre los tratamientos alternativos, incluyendo los físicos, no hay una solución con la sencillez, la productividad, la eficiencia y el costo competitivo como el mechado básico. Por tanto, se espera que esta práctica siga existiendo, incluso por un tiempo ilimitado si fuese posible.
[Cortesía de Dr. J.A. Scott]
La limpieza y desinfección de los materiales de bodega
Los equipos de bodega y los depósitos almacenadores de vino representan el principal reservorio de Brettanomyces en el vino. Es a partir de estos reservorios que la contaminación, limitada a un lote de vino en el inicio, puede ser ampliada a discreción hacia todo el volumen a partir de los movimientos de los vinos y el uso de los equipos de bodega. La desinfección de los mismos es crucial para el control de estos gérmenes, pero ninguna desinfección es efectiva salvo después de una limpieza suficiente. La situación es más complicada en la madera, que tiene un área de desarrollo mucho mayor que el acero inoxidable o la resina epoxi. Además, este material es delicado y los procedimientos de limpieza y desinfección no deben degradarla. Este monográfico dedicará un artículo al tema en próximas actualizaciones y se remite a los lectores a su consulta para obtener toda la información necesaria.
Coinoculación levaduras/bacterias propias de la fermentación alcohólica y maloláctica
A pesar de todos los avances en el control de la fermentación maloláctica, siguen existiendo problemas en su inducción en algunos vinos. La presencia de alcohol y de otros compuestos tóxicos para las bacterias lácticas que son productos de la fermentación alcohólica, el pH bajo y la competencia con levaduras, hacen del vino un medio hostil para los cultivos iniciadores. Desde el principio se consideró que la adición de bacterias lácticas antes de la finalización de la fermentación alcohólica representa un riesgo para que las bacterias degraden azúcares y provoque el nombrado picado láctico. Algunos autores (Beelman y Kunkee, 1985; King y Beelman, 1986) han realizado estudios que demuestran que la coinoculación de las bacterias lácticas con levaduras no solo no implica antagonismo entre ellas, sino que incluso las bacterias lácticas se aclimatan mejor. La ausencia de etanol y el contenido en nutrientes del mosto, consiguen que la población de bacterias lácticas se aclimate mejor al medio y la fermentación maloláctica se desarrolla mejor, impidiendo además el desarrollo de Brettanomyces entre ambas fermentaciones, por lo que empieza a ser una práctica cada vez más popular en bodega, aunque solo sea por esta razón.
Control curativo de Brettanomyces
Tratamientos físicos y térmicos
El tratamiento térmico de vino, también llamado pasteurización flash, es una técnica eficaz para la destrucción de todos los tipos de microorganismos. Las condiciones de procesamiento deben adaptarse a las características de resistencia de cada uno. Las características de destrucción térmica de Brettanomyces son conocidas y dependen de las condiciones ambientales. El tiempo de reducción decimal (RD) es de 0,3 a 0,4 minutos a 55 °C cualquiera que sea el estado fisiológico de las células, el factor Z, que reduce la temperatura de muerte (DT) por 10, es de 5 °C. Estos parámetros también se pueden aplicar a la desinfección térmica de barricas. Pero una vez tratado, hay que considerar que el vino puede contaminarse de nuevo con facilidad. Además, el calentamiento del vino durante unos segundos, seguido de su enfriamiento, debe hacerse perfectamente libre de aire para no causar una oxidación perjudicial. Este proceso es ventajoso para bloquear un fulgurante desarrollo en los vinos jóvenes, eventualmente dulces y difíciles de filtrar.
Tratamientos físicos filtrantes
La filtración es una técnica clásica llevada a cabo para eliminar microorganismos. La calidad del resultado depende de la porosidad de los medios filtrantes, que debe adaptarse a los microorganismos diana. En el caso de Brettanomyces, especialmente al final de la crianza del vino, las células son pequeñas y requieren un filtro con un poro de menos de 1 µ (idealmente menos de 0,65 µ) si queremos garantizar la eliminación total. Es ridículo pensar que la filtración puede afectar negativamente a la calidad del vino si está bien realizada y bien diseñada. Si la filtración a este nivel de porosidad afecta gravemente a la calidad, es que esta calidad está basada, por su tamaño, en los elementos muy poco estables… De hecho, la colmatación es perjudicial para la calidad, es decir, la filtración sobre presión en un medio de baja porosidad, puede eliminar elementos positivos para la calidad sensorial. Para evitar afectar a la calidad del vino adversamente durante la filtración, a menudo es necesario proceder a etapas sucesivas de filtración (3 y 1 µ), a una prefiltración, o a un pretratamiento enzimático para evitar la obstrucción del medio y la esterilización del vino. La medida única de la turbidez no informa sobre la filtrabilidad real del vino. La determinación del índice de colmatación puede ayudar a adaptar la estrategia para preparar el vino antes de su filtración. Por lo tanto, la filtración está especialmente recomendada antes del embotellado, cuando el vino tiene un perfil de riesgo determinado o cuando ha sido detectada la presencia de una población de Brettanomyces durante un control antes de su trasiego (véase más adelante).
Otros tratamientos curativos físicos
Se han propuesto y ensayado otros tratamientos físicos, como la esterilización UV (germicida UV-A), que no es adecuado para el tratamiento de vinos tintos debido a la fuerte absorción de la radiación ultravioleta por los polifenoles presentes. El tratamiento de alta presión (destrucción de células más allá de 200 MPa) es ciertamente eficaz, pero extremadamente costoso, sin proporcionar suficiente flujo (tratamiento discontinuo). El tratamiento por electroporación (perforación de las membranas celulares bajo el efecto de una diferencia de potencial aplicada en una celda en tratamiento continuo) también tiene cierta eficacia, pero, de nuevo, la falta de equipamiento disponible y los altos costes de procesamiento, limitan significativamente el valor práctico de esta tecnología actualmente.
Utilización del quitosano fúngico
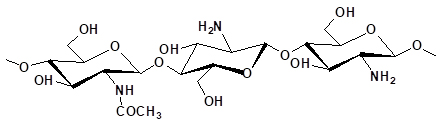
El quitosano es un polímero natural de N-acetilglucosamina, derivado de la quitina desacetilada química o enzimáticamente (fig. 2). La quitina se encuentra especialmente en los caparazones de los crustáceos, cefalópodos y en la pared de los hongos filamentosos. El tratamiento de la quitina produce el quitosano. Este polímero debe tener un cierto grado de desacetilación muy especial para ser eficaz vis-a-vis frente a Brettanomyces/Dekkera. El grado de desacetilación del quitosano también afecta a la solubilidad y la viscosidad de la suspensión.
Actualmente, solo el quitosano de origen fúngico, que puede estar acompañado por más o menos β-glucanos, se permite por parte de la OIV en vinificación.
La principal fuente de quitosano en el mundo, a saber, es la fuente animal, mucho más abundante y menos cara, pero no está sujeto a una aprobación y, por lo tanto, está prohibido. Es probable que el potencial alergénico de los crustáceos en contra de los hongos sea el motivo de su no autorización. Sin embargo, el quitosano de los crustáceos/cefalópodos también se usa ampliamente en la industria alimentaria y la farmacéutica sin restricciones. Por tanto, es válido verificar las posibilidades para que el quitosano de origen animal sea permitido en su uso enológico, lo que puede abaratar su utilización.
El modo exacto de acción del quitosano es desconocido. Su acción puede deberse a que este polímero catiónico se une a las paredes de Brettanomyces/Dekkera en receptores relativamente específicos (efecto físico) y causa una alteración de la integridad de la membrana (efecto biológico); Saccharomyces sp. o Oenococcus sp., presentes al mismo tiempo, no se ven afectados, por lo que se puede considerar su utilización durante la vinificación en el caso de fermentaciones problemáticas o cuando se sufren retrasos en la finalización de la fermentación maloláctica. Durante la crianza, el quitosano en una dosis de 4 a 6 g/hL puede destruir poblaciones grandes de Brettanomyces en unos pocos días; las células destruidas entonces no pueden formar etilfenoles. Sin embargo, dado el carácter insoluble del quitosano activo vis-a-vis frente a Brettanomyces, su eficacia suele ser más elevada y posee una mayor duración de la protección en grandes envases que en pequeños contenedores. Su sedimentación es más rápida en las barricas, por lo que puede requerirse una puesta regular en suspensión (agitación) para mantener su actividad. Su tendencia a causar una pequeña desacidificación de los vinos, hay que tenerla en cuenta.
Utilización de dimetil-dicarbonato (DMDC)
Aparte del dióxido de azufre, como el único antiséptico químico utilizado en el vino, se encuentra el dicarbonato de dimetilo. Este producto (llamado Velcorin™) se hidroliza rápidamente en el vino y, por lo tanto, es pertinente en la esterilización en frío para la sustitución de la filtración o de los tratamientos térmicos antes de ser el vino embotellado. Uno de los productos de hidrólisis, el metanol, limita la dosis máxima utilizable, que no puede exceder para que su concentración no sobrepase la máxima permitida en los vinos tintos (300 mg/L). Este límite de utilización ha sido validado especialmente como alto. Se debe utilizar por lo menos 250 mg/L (lo que representa una liberación de más de 110 mg/L de metanol) para asegurar un buen rendimiento frente a Brettanomyces/Dekkera.
También debemos recordar que, por ahora, el uso de DMDC se limita a los vinos que contienen más de 5 g/L de azúcar residual. Su uso está limitado al momento del embotellado, pero esta técnica da excelentes resultados a largo plazo y elimina la necesidad de filtración esterilizante de vinos más difíciles de manejar.
Utilización de antibióticos y biocidas
El uso de antibióticos está prohibido desde los orígenes de la reglamentación en la enología. La natamicina o pimaricina es una toxina antihongos producida naturalmente por algunas bacterias del género Streptomyces, sin embargo, figura como un aditivo (E235) utilizado ampliamente en la industria alimentaria (lo que es cierto solo para el tratamiento externo de algunos quesos y embutidos secos). A pesar de su eficacia, su uso está totalmente prohibido en el vino. Ha existido una grave crisis ocurrida recientemente en América del Sur (especialmente en Argentina) por el uso incontrolado de este producto. El uso de toxinas killer producidas por levaduras pertenecientes más o menos al microbiota natural del vino (Kluyveromyces wickerhamii, Pichia anomala) mostró cierta eficacia en los laboratorios que las experimentaron. Otros péptidos (derivados de la lactoferrina bovina) también mostraron una toxicidad vis-a-vis, pero con diferentes eficiencias dependiendo de la cepa. Estas soluciones representan vías interesantes para el control biológico en un futuro quizás próximo.
Tratamientos para retirar los etilfenoles
La clarificación del vino es una práctica comúnmente usada en bodega para la limpieza del vino. Para ello, se pueden utilizar productos adsorbentes de uso en enología; el PVPP a dosis de 60-480 mg/L y el carbón enológico de origen vegetal desodorante a dosis de 15-240 mg/L han sido utilizados para eliminar en parte el contenido en fenoles volátiles, si bien, las dosis a emplear para tener resultados significativos son demasiado elevadas y los efectos colaterales a nivel organoléptico son importantes por su agresividad sobre el vino. También se han empleado polímeros de celulosa, como el acetato y propionato de celulosa, con reducciones del 30%.
En soluciones modelo el empleo de levaduras secar activas (LSA) como clarificantes han conseguido eliminar proporciones importantes los fenoles volátiles, sin embargo, las dosis para conseguirlo son muy elevadas, lo que encarece la aplicación, además de tener también efectos colaterales sobre la calidad del vino. En esta línea, también se han ensayado cortezas de levaduras específicas con la idea de tener una mayor superficie absorbente, pero los resultados no son muy prometedores por el momento.
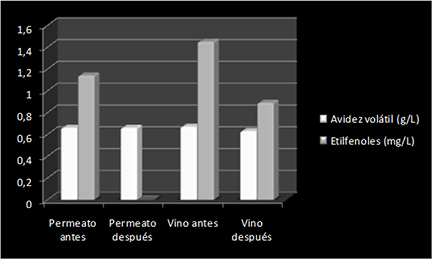
La técnica que parece más eficaz en cuanto a la eliminación selectiva de etilfenoles es la nanofiltración del vino, con la que se puede obtener un permeato con un 35-40% de los etilfenoles totales del vino y la posterior retención en resinas específicas para que estos sean eliminados por retención. A modo de ejemplo mostramos los resultados de una prueba industrial sobre un vino tempranillo 2009 con crianza en barrica (fig. 3). El contenido inicial del vino en etilfenoles era de 1,4 mg/L, después del tratamiento bajo a 0,81 mg/L gracias a la retención total de dichos compuestos al pasar a través de la resina específica una vez obtenido el permeato con nanofiltración tangencial.
Conclusión
La levadura contaminante Brettanomyces/Dekkera ha encontrado en el mundo del vino un hábitat perfecto donde desarrollarse, extendiéndose su presencia por todos los países elaboradores. Los elementos tecnológicos que influyen en su crecimiento están siendo cada vez mejores conocidos, lo que favorece su control. No obstante, tal vez debido a un debate con ciertas controversias, la proporción de vinos tintos alterados con carácter fenolado no va en detrimento de su frecuencia de aparición.
El necesario control de Brettanomyces en el vino pasa por la realización de análisis microbiológicos y químicos, en este orden, para así poder evitar la aplicación de métodos curativos demasiado erosivos para la calidad del vino. No es necesario que las bodegas deban renunciar completamente a la presencia de Brettanomyces como microbiota natural de los ambientes de bodega, pero sí es muy conveniente aprender a gestionar su eventual presencia en un nivel que genere cierta seguridad durante la fermentación y la crianza del vino. Para ello, se deben seguir ciertas recetas y normas de sentido común y tecnológicas ampliamente desarrolladas científicamente, comenzando con la viticultura, que es a menudo le gran olvidada, o peor aún, ignorada, y a continuación, llevar a cabo procesos microbianos bien definidos y controlados. Además, existen formas de diagnóstico y evaluación del potencial riesgo de contaminación bien definidas según sean los focos de atención: el vino, las barricas o el ambiente de bodega.
Una buena profilaxis en la supervisión general y precisa de cada paso es la clave para utilizar métodos más adecuados en el control completo de un microorganismo muy brillante como oportunista y que parece adecuarse perfectamente a las condiciones del vino. El mínimo error, o relajarse, promueve que Brettanomyces/Dekkera siempre esté ahí para llenar un vacío que la naturaleza aborrece.
Bibliografía consultada
. Chatonnet P, Viala C, Dubourdieu D. Influence of polyphenolic components of red wine on the microbial synthesis of volatile phenols. Am J Enol Vitic 1997; 48 (4): 443-8.
. Chatonnet P, Masneuf I, Gubbiotti MC, Dubourdieu D. Prévention et détection des contaminations par Brettanomyces au cours de la vinification et de l’élevage des vins. Rev Franç Oenol 1999; 179: 20-4.
. Chatonnet P, Dubourdieu D, Boidron J-N. 1995 The influence of Brettanomyces/Dekkera sp. yeasts and lactic acid bacteria on the ethylphenol content of red wines. Am J Enol Vitic 1995; 46: 463-8.
. Chatonnet P, Boidron JN, Dubourdieu D. Influence des conditions d’élevage et de sulfitage des vins rouges en barriques sur la teneur en acide acétique et en éthylphénols. J Int Vigne Vin 1993; 17: 277-98.
. Chatonnet P. Nettoyage et désinfection appliquées aux contenants vinaires en bois destinés à la vinification et à l’élevage : partie 2/3 : Nécessités, principes et méthodes de désinfection du bois au contact du vin. Revue des Œnologues 2010; 137: 38-43.
. Couto JA, Neves F, Campo F, Hogg T. Thermal inactivation of the wine spoilage yeasts Dekkera/Brettanomyces. Int J Food Microbiol 2005; 10 (3): 337-44.
. Romat H. Coefficient de colmatage Partie ½ Une nouvelle approche de la filtrabilité des vins. Revue des Œnologues 2007; 123: 31-3.
. Romat H. Proposition de critères de filtration en fonction du coefficient de colmatage. Revue des Œnologues 2007; 124: 36-38.
. Romat H. Notions de rhéologie en œnologie. Application à l’influence de la température sur la viscosité et ses conséquences sur quelques pratiques œnologiques et sur la filtrabilité du vin. Revue des Œnologues 2011; 138: 15-7.
. Gomez L, Escudero I, Aguilar M, Hayward P, Mendoza P, Ramirez M. Selective antimicrobial action of quitosan gain spoilage yeasts in mixed culture fermentations. J Ind Microbiol Biotechnol 2004; 31: 16-22.
. Comintini F, Ingeniis J, Pepe L, Mannazzu I, Ciani M. Pichia anomala and Kluyveromyces wickerhamii killer toxins as new tool against Dekkera/Brettanomyces spoilage yeasts. FEMS Microbiol Letters 2004; 238: 235-40.
. Enrique M, Marcos F, Martinez M, Valles S, Planzmes P. Inhibition of the wine spoilage microorganism Dekkera/Brettanomyces by bovine-lactoferrin derived peptides. Int J Food Microbiol 2009; 127 (3): 229-34.
. Chatonnet P, Fleury A. Nouvelles méthodes et nouvelles application du contrôle microbiologique en quasi temps réel par utilisation de la technologie Excell Gen®. Revue des Œnologues 2008; 129: 23-7.