En estudios recientes, realizados en medios sintéticos de laboratorio, se ha evaluado el efecto de algunos compuestos fenólicos (fundamentalmente ácidos fenólicos y sus ésteres y algunos flavanoles, como la catequina) sobre ciertas especies de bacterias lácticas del vino, y se ha puesto de manifiesto que a concentraciones de estos compuestos del orden de las que se encuentran en el vino, se estimula el crecimiento bacteriano. Por el contrario, a concentraciones elevadas, los compuestos fenólicos resultan tóxicos para la célula bacteriana, lo que parece ser la causa de la inhibición de su crecimiento. La estimulación o inhibición del crecimiento de bacterias lácticas por algunos compuestos fenólicos de los vinos plantea la cuestión de si éstos intervienen de alguna manera en el desarrollo de la fermentación maloláctica (FML) en el vino y, por otro lado, la posibilidad de evaluar su uso como antimicrobianos naturales durante la vinificación.
Las bacterias lácticas del vino y la fermentación maloláctica
Junto con las levaduras, las bacterias lácticas son los microorganismos con mayor implicación en la elaboración del vino. Las levaduras son responsables de la fermentación alcohólica, mientras que las bacterias lácticas realizan el proceso de FML que, si las condiciones son favorables, tiene lugar una vez finalizada la fermentación alcohólica. Los trabajos emprendidos en los últimos años, y especialmente a partir de la década de los ochenta, han confirmado el papel esencial de la FML en la vinificación, no sólo por disminuir la acidez del vino, lo que es prácticamente imprescindible en los vinos tintos, sino también por su contribución a la estabilidad microbiológica del producto final y a su calidad organoléptica.1-3
Las bacterias lácticas están presentes durante todas las etapas de la elaboración del vino. Se pueden aislar de las hojas de la viña, de la uva, del equipamiento de la bodega, de las barricas, etc. Las bacterias presentes en las primeras fases de la vinificación (mosto y principio de la fermentación) pertenecen a varias especies, generalmente homofermentativas. Las más abundantes son Lactobacillus plantarum, L. casei, L. hilgardii, Leuconostoc mesenteroides y Pediococcus damnosus. En menor proporción se encuentran Oenococcus oeni y Lactobacillus brevis. En el tiempo que transcurre entre el final de la fermentación alcohólica y el inicio de la maloláctica tiene lugar la fase de multiplicación de las bacterias. En esta fase influyen fundamentalmente el pH del medio, el contenido en SO2, la temperatura y la concentración de etanol.4 Las condiciones particulares de cada vino, fundamentalmente el contenido en compuestos fenólicos, podría también afectar al crecimiento de las bacterias lácticas5 sin que todavía se conozca suficientemente este efecto. La especie bacteriana que predomina al final de la fermentación alcohólica es O. oeni. Esta es la especie mejor adaptada al crecimiento en las condiciones difíciles impuestas por el medio (bajo pH y elevada concentración de etanol) 6-7 y es, por tanto, la principal responsable del desarrollo de la FML en la mayor parte de los vinos. Sin embargo, algunas cepas de los géneros Pediococcus y Lactobacillus también pueden sobrevivir en esta fase. Después de la FML, la supervivencia de las bacterias dependerá de las condiciones del medio, especialmente del pH, del contenido en etanol y sobre todo de la concentración de SO2. Por ello, es una práctica habitual la eliminación de las bacterias lácticas mediante el sulfitado, una vez que todo el ácido málico del vino ha sido degradado. Los niveles de anhídrido sulfuroso necesarios para frenar la actividad de las bacterias lácticas oscilan entre los 10 y 30 mg/L de SO2 libre en el caso de los vinos de pH comprendido entre 3,2 y 3,6 y entre 30-50 mg/L para vinos con pH comprendido entre 3,5-3,7. Si se trata de vinos con pH superiores, lo que es cada vez más frecuente en los vinos tintos, la dosis necesaria de SO2 libre puede llegar a valores cercanos a los 100 mg/L.8
En determinadas ocasiones, durante la elaboración del vino, el desarrollo de las bacterias lácticas y la FML resulta impredecible ya que puede producirse durante la fermentación alcohólica o incluso durante la conservación o envejecimiento. Debido al metabolismo de estas bacterias, se producen cambios en la composición del vino que se traducen en una alteración de su calidad convirtiéndolo, en algunos casos en un producto inaceptable para su consumo. Entre ellas, se ha descrito el conocido «picado láctico», la producción de olores indeseables debidos a la formación de fenoles volátiles o de bases heterocíclicas aromáticas,9,10 y la formación de aminas biógenas tóxicas.11-13 Se han identificado cepas pertenecientes al grupo de los Lactobacillus y Pediococcus, como causantes de estos problemas. Por ello, en la producción del vino tiene un especial interés ejercer un buen control de la FML para evitar posibles alteraciones bacterianas. Por otro lado, aunque la FML resulta en ocasiones difícil de inducir en las bodegas, la prevención o inhibición del crecimiento y desarrollo de las bacterias lácticas en el vino es asimismo una tarea complicada.
Empleo del SO2 y otros compuestos complementarios para controlar el crecimiento de bacterias lácticas en enología
El anhídrido sulfuroso o dióxido de azufre (SO2) presenta múltiples propiedades como conservante en la elaboración de los vinos, entre las que se pueden destacar los efectos antioxidante y antimicrobiano selectivo especialmente frente a bacterias lácticas. Por ello, constituye un tratamiento indispensable en la tecnología de elaboración y conservación de los vinos. Sin embargo, el empleo de este compuesto está estrictamente regulado puesto que, a dosis elevadas, puede dar lugar a modificaciones organolépticas en el producto final (olores defectuosos producidos por el propio gas sulfuroso, o por su reducción a sulfhídrico y otros mercaptanos) y, fundamentalmente, a riesgos para la salud humana. La dosis máxima autorizada por la Organización Internacional de la Viña y el Vino (OIV) es de 150 a 400 mg/L de SO2 total dependiendo del tipo de vino y de su contenido en materias reductoras. La Unión Europea14 establece que los límites del contenido total de SO2 en los vinos tintos no podrá exceder 160 mg/L, y en blancos y rosados, 210 mg/L. Por otra parte, en Estados Unidos, y recientemente también en la Unión Europea (en concreto desde el 26 de noviembre de 2005, Reglamento nº 1991/2004), la legislación obliga a los elaboradores a señalar la presencia de sulfitos en el etiquetado de los vinos, siempre y cuando su nivel exceda los 10 mg/L. De hecho, en los vinos españoles, es cada vez más frecuente encontrar la indicación «contiene sulfitos» en un lugar visible de la etiqueta.
Debido a estos efectos, en los últimos años, existe una tendencia a reducir progresivamente los niveles máximos autorizados en los mostos y en los vinos. Aunque en la actualidad ningún compuesto conocido puede desplazar al SO2 en todas sus propiedades enológicas, existe un gran interés por la búsqueda de otros conservantes inocuos para la salud que puedan sustituir, o al menos complementar, la acción del SO2 permitiendo su reducción en los vinos.
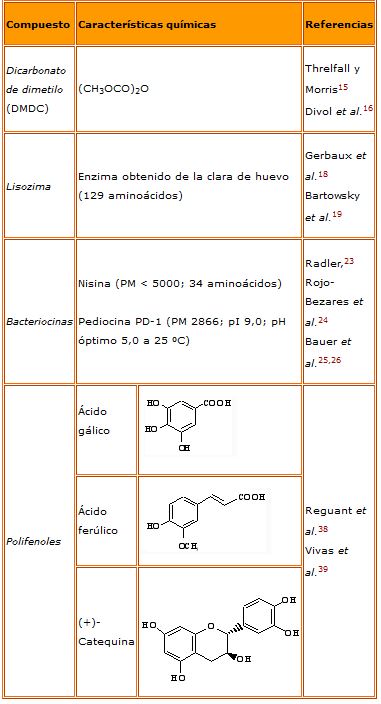
En lo que se refiere a productos con actividad antimicrobiana complementarios al SO2 (tabla 1), recientemente se ha descrito la utilidad del dicarbonato de dimetilo para inhibir la fermentación alcohólica y el desarrollo de levaduras, lo que permite disminuir la dosis de SO2 en algunos vinos.15,16 Se ha comprobado que las células de levaduras mueren después de adicionar este compuesto, mientras que con el SO2 entran en un estado que se ha denominado «viable pero no cultivable»,16 que también han observado algunos autores en el caso de las bacterias lácticas.17 Se han introducido otras alternativas basadas en «antimicrobianos naturales», activos frente a bacterias lácticas, entre las que ha recibido especial interés el empleo de lisozima,18,19 y de algunos péptidos antimicrobianos o bacteriocinas.20,21 En el caso de la lisozima, desde su autorización como aditivo en la vinificación, su utilización en las bodegas se ha visto muy limitada debido a los altos costes de su aplicación. Otro aspecto a tener en cuenta de esta proteína es que puede provocar en algunos individuos reacciones inmunes mediadas por IgE,22 por lo que su presencia en los alimentos, incluido el vino, es motivo de preocupación. Hasta el momento actual, la nisina es la única bacteriocina que se puede obtener comercialmente y, aunque se ha demostrado su efectividad en la inhibición del crecimiento de bacterias lácticas del vino23 así como de bacterias acéticas y algunas levaduras alterantes,24 su empleo en enología no está autorizado. Se han descrito otras bacteriocinas para controlar el crecimiento de las bacterias lácticas en el vino aunque la posible eficacia de estos compuestos, su modo de acción y especialmente su estabilidad durante la vinificación, está todavía en fase de exploración.25,26
Los compuestos fenólicos del vino
Los compuestos fenólicos o polifenoles son constituyentes naturales de la uva y de los vinos. Con el nombre de polifenoles se agrupan numerosos compuestos con diferente estructura química: ácidos hidroxibenzoicos, ácidos hidroxicinámicos, estilbenos, alcoholes, flavanoles, flavonoles, antocianos y taninos. Estos compuestos tienen un gran interés ya que son responsables de muchas de las propiedades organolépticas de los vinos, fundamentalmente el color y la astringencia. Los polifenoles del vino también se asocian con los efectos fisiológicos beneficiosos derivados del consumo moderado de vino, especialmente con relación a las enfermedades cardiovasculares. En cualquier caso, la estructura de un compuesto fenólico determina su reactividad química y sus propiedades biológicas.
La concentración de compuestos fenólicos en el vino está condicionada por diversos factores relacionados con la uva (variedad, calidad de la vendimia, suelo, clima, etc.) y por las prácticas enológicas. Durante la vinificación, factores como el tiempo y la temperatura de maceración, la fermentación en contacto con los hollejos y pepitas, la adición de enzimas, la concentración de SO2, el prensado, etc., afectan a la extracción de los compuestos fenólicos de la uva al mosto/vino.27 La FML también afecta la composición fenólica del vino disminuyendo el contenido de antocianos y polifenoles totales.28 Durante el envejecimiento en botella, los antocianos del vino descienden, aunque el contenido de polifenoles totales sufre menos variaciones.29,30 Todo ello hace que el contenido total de polifenoles se sitúe alrededor de 150-400 mg/L para los vinos blancos y 900-1400 mg/L para los vinos tintos jóvenes.
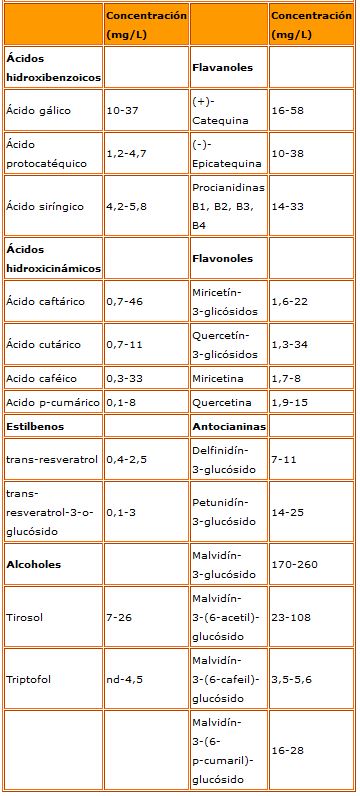
A modo de resumen, la tabla 2 recoge el rango de variación de las concentraciones de los principales compuestos fenólicos identificados en vinos tintos jóvenes. Por grupos de compuestos, los ácidos y derivados hidroxibenzoicos representarían el 6 % del total; los ácidos y derivados hidroxicinámicos, 1,1 %; los estilbenos, 0,5 %; los alcoholes, 3,8 %; los flavanoles, 15 %; los flavonoles, 3,6 %; y las antocianinas, 70 %. En proporción muy inferior se encuentran otros derivados antociánicos como los piranoantocianos.
Interacciones entre compuestos fenólicos y bacterias lácticas
La mayoría de los estudios realizados hasta el momento sobre interacciones entre compuestos fenólicos y bacterias lácticas en vinos, se refieren al metabolismo de los ácidos hidroxicinámicos (ácidos ferúlico y cumárico) por distintas especies bacterianas, que se traduce en la formación de fenoles volátiles (4- etilguaiacol y 4-etilfenol).31-33 También se ha estudiado el metabolismo de otros compuestos fenólicos como el ácido gálico y la catequina34,35 y la transformación de los ésteres de los ácidos hidroxicinámicos a sus correspondientes ácidos libres.36,37 Sin embargo, muy poco se conoce el efecto de los compuestos fenólicos de los vinos sobre el crecimiento y metabolismo de los microorganismos en general y, en particular, de las bacterias lácticas que participan en el proceso de vinificación. Se ha sugerido que los compuestos fenólicos pueden comportarse como activadores o inhibidores del crecimiento bacteriano dependiendo de su estructura química (sustituyentes en el anillo fenólico) y concentración.38,39 Así, por ejemplo, en L. hilgardii se ha demostrado, en sistemas modelo, que el ácido gálico y la catequina, a las concentraciones a las que se encuentran en los vinos, no sólo estimulan el crecimiento sino que aumentan la población bacteriana, lo que se puede relacionar con la capacidad de metabolizar estos compuestos durante la fase de crecimiento que proporciona energía a la célula.40 También pueden actuar sobre el metabolismo de la bacteria,5,41,42 ya que favorecen la utilización de los azúcares y del ácido málico.40 Por otro lado, a concentraciones más elevadas, estos compuestos ejercen un efecto negativo sobre el desarrollo bacteriano. O. oeni parece más sensible a la inactivación por compuestos fenólicos que L. hilgardii.43
Los ácidos hidroxicinámicos libres afectan al crecimiento de L. plantarum y algunas especies alterantes del grupo de los Lactobacillus. El ácido ferúlico parece ser más efectivo que el ácido p-cumárico y que el ácido cafeico, aunque algunas especies son más susceptibles que otras a este efecto. Por el contrario, los ésteres de estos ácidos al igual que el ácido no fenólico, el ácido quínico, no influyeron en el crecimiento de L. plantarum.44 Además, en un medio sintético de laboratorio, se ha comprobado que la concentración de estos compuestos puede tener un efecto crítico ya que la bacteria es capaz de tolerar y metabolizar concentraciones comprendidas entre 100-250 mg/L, lo que podría explicar el efecto beneficioso de estos compuestos en el crecimiento. Para concentraciones por encima de 500 mg/L, se produce un efecto tóxico.45
Propiedades antimicrobianas de los compuestos fenólicos
El incremento de la resistencia de patógenos aislados de humanos y animales, en combinación con la creciente preocupación de los consumidores por la utilización de productos químicos como agentes conservantes, ha hecho que en los últimos años se evalúe el empleo de nuevos productos antimicrobianos eficientes sin efectos colaterales para la salud. En este sentido, el estudio de las propiedades antimicrobianas de diferentes extractos fenólicos obtenidos de plantas46-48 y frutas49,50 ha cobrado fuerza paulatinamente. Recientemente han aparecido algunos estudios en la bibliografía en los que se comprueba en medios de cultivo la actividad antimicrobiana de diferentes extractos fenólicos obtenidos a partir de productos enológicos como pepitas de uva51 y vino blanco y tinto52 frente a bacterias patógenas. Se ha descrito que los extractos con actividad antimicrobiana (en los que predominan ácidos fenólicos) son más activos frente a bacterias que frente a levaduras, lo que sugiere una mayor resistencia de las levaduras a la acción de estos compuestos. Incluso se ha hecho algún intento para la obtención mediante tecnologías «limpias», como es la extracción con fluidos supercríticos, de fracciones fenólicas a partir de pepitas, con un amplio espectro de actividad frente a bacterias lo que podría ser una primera aproximación para su posible desarrollo y aplicación industrial.53,54
Como se ha mencionado anteriormente, la eficacia de los compuestos fenólicos como antimicrobianos frente a bacterias lácticas en el vino depende de la estructura del compuesto (tabla 1) y es dosis dependiente. En general, también parece que el efecto antimicrobiano se conseguiría con dosis más elevadas a las que estos compuestos se encuentran en los vinos. Dicho esto, tenemos que pensar que la aplicación de extractos fenólicos como antimicrobianos en enología estaría condicionada por los posibles cambios que concentraciones efectivas de estos compuestos producirían en las propiedades físico-químicas (solubilidad) y organolépticas (color y aroma) del vino. Sin embargo, es importante destacar que los estudios llevados a cabo hasta ahora se han realizado en medios de cultivo, en los que el crecimiento bacteriano se ve favorecido por la composición y pH de los mismos; es de esperar que la concentración de compuestos fenólicos necesaria para inhibir el crecimiento bacteriano sea inferior en un medio adverso como es el vino. Por otro lado, la actividad antimicrobiana de los compuestos fenólicos podría aumentar por efectos sinérgicos entre ellos o con otros agentes antimicrobianos, como el propio SO2, lo que permitiría disminuir la dosis a emplear de cada uno de los mismos. Finalmente, a la hora de evaluar el efecto de un compuesto fenólico, es muy importante tener en cuenta la presencia en el vino de otros compuestos como proteínas, azúcares y agentes oxidantes que pueden interaccionar con el compuesto en estudio y, por tanto, tener incidencia en su actividad. En cualquier caso, son necesarios estudios que tengan en cuenta todos estos factores.
Con este enfoque, estamos trabajando en un proyecto de investigación denominado: «Efecto de los polifenoles en el crecimiento y metabolismo de bacterias lácticas en vino. Potencial aplicación como aditivos antimicrobianos en enología». La finalidad del proyecto es lograr una mayor comprensión sobre el efecto que, en base a su estructura química, tienen los polifenoles en el crecimiento y metabolismo de las bacterias lácticas en el vino, para dilucidar hasta qué punto intervienen en el proceso de fermentación maloláctica. El estudio se centra en los distintos grupos de compuestos fenólicos presentes en los mostos y los vinos, y en las principales especies bacterianas presentes durante la vinificación. Se está evaluando el impacto de las interacciones polifenol-bacteria láctica que pueden producirse en condiciones enológicas, así como el/los mecanismo/s de las mismas. También se comprobará el posible efecto frente a otros microorganismos alterantes del vino, especialmente levaduras del género Brettanomyces, y frente a bacterias acéticas. En último término, se pretende explorar la posibilidad de emplear extractos fenólicos obtenidos a partir de plantas, incluida la vid, que demuestren efectos antimicrobianos frente a bacterias lácticas, como aditivos o adyuvantes naturales durante la vinificación, a modo de alternativa total o parcial a los tratamientos tradicionales basados principalmente en el uso de SO2.
Agradecimientos
Los autores agradecen la financiación del Ministerio de Educación y Ciencia (proyectos AGL2006-04514 y PETRI95-0759 OP), y de la Comunidad de Madrid (Proyecto S-0505/AGR/0153).
Bibliografía
1 Versari, A.; Parpinello, G.P. y Cattaneo, M.: «Leuconostoc oenos and malolactic fermentation in wine: a review», J. Ind. Microbiol. Biotechnol. 1999; 23: 447-455.
2 Maicas, S.: «The use of alternative technologies to develop malolactic fermentation in wine», Appl. Microbiol. Biotechnol. 2001; 56: 35-39.
3 Moreno-Arribas, M.V. y Polo, M.C.: «Winemaking microbiology and biochemistry: Current knowledge and future trends», Cr. Rev. Food Sci. 2005; 45: 265-286.
4 Boulton, R.B.; Singleton, V.L., Bisson, L.F. y Kunkee, R.E.: Principles and practices of winemaking, Nueva York: Chapman Hall, 1996.
5 Vivas, N.; Augustín, M. y Lonvaud-Funel, A.: «Influence of oak Word and grape tannins on the lactic acid bacterium Oenococcus oeni (Leuconostoc oenos, 8413), J. Sci. Food Agric. 2000; 80: 1675-1678.
6 Davis, C.R.; Wibowo, D.; Eschenbruch, R.; Lee, T.H. y Fleet, G.H.: «Practical implications of malolactic fermetnation: A review», Am. J. Enol. Vitic. 1985; 36: 290-301.
7 Van Vuuren, H.J.J. y Dicks, L.M.T.: «Leuconostoc oenos: a review», Am. J. Enol. Vitic. 1993; 44: 99-112.
8 Zamora, F.: «El anhídrido sulfuroso; algunas reflexiones sobre este aditivo», ólogos 2005; 38.
9 Chatonet, P.; Dubourdieu, D. y Boidron, J.N.: «The influence of Brettanomyces/Dekkera sp. yeasts and lactic acid bacteria on the ethylphenol content of red wine», Am. J. Enol. Vitic. 1995; 46: 463-468.
10 Costello, P.J. y Henschke, P.A.: «Mousy off-flavor of wine: Precursors and biosynthesis of the causative N-heterocycles 2-ethyltetrahydropyridine, 2-acetyltetrahydropyridine, and 2-acetyl-1-pyrroline by Lactobacillus hilgardii DSM 20176», J. Agric. Food Chem. 2002; 50: 7079-7087.
11 Moreno-Arribas, M.V.; Torlois, S.; Joyeux, A.; Bertrand, A. y Lonvaud-Funel, A.: «Isolation, properties and behaviour or tyramine-producing lactic acid bacteria from wine», J. Appl. Microbiol. 2000; 88: 584-593.
12 Landete, J.M.; Ferrer, S.; Polo, L. y Pardo, L.: «Biogenic amines in wines from three Spanish regions», J. Agric. Food Chem. 2005; 53: 1119-1124.
13 Marcobal, A.; Polo, M.C.; Martín-Álvarez, P.J.; Muñoz, R. y Moreno-Arribas, M.V.: «Formation of biogenic amines during red wine manufacture», J. Food Prot. 2006; 69: 391-396.
14 Reglamentos de la Comunidad Europea nº 1493/1999 y 1622/2000, por los que se establece la Organización Común del Mercado Vitivinícola, que regulan los límites del contenido total de anhídrido sulfuroso en los distintos tipos de vinos.
15 Threlfall, R.T. y Morris, J.R.: «Using dimethyldicarbonate to minimize sulphur dioxide for prevention of fermentation from excessive yeast contamination in juice and semi-sweet wine», J. Food Sci. 2002; 67: 2758-2761.
16 Divol, B.; Strehaiano, P. y Lonvaud-Funel, A.: «Effectiveness of dimethyldicarbonate to stop alcoholic fermentation in wine», Food Microbiol. 2005; 22:169-178.
17 Millet, V. y Lonvaud-Funel, A.: «The viable but non-cultivable state of wine micro-organisms during storage», Lett. Appl. Microbiol. 2000; 30:136-141.
18 Gerbaux, V.; Villa, A.; Monamy, C. y Bertrand, A.: «Use of lysozyme to inhibit malolactic fermetnation and to stabilize wine after malolactic fermentation», Am. J. Enol. Vitic. 1997; 48: 49-54.
19 Bartowsky, E.: «Lysozyme and winemaking», Aus. J. Grape Wine Res. 2003; 473a: 101-104.
20 Navarro, L.; Zarazaga, M.; Sáenz, J.; Ruiz-Larrea, F. y Torres, C.: «Bactericin production by lactic acid bacteria isolated from Rioja red wines», J. Appl. Microbiol. 2002; 88: 44-51.
21 Du Toit, M.; du Toit, C.; Krieling, S.J. y Pretorius, I.S.: «Biopreservation of wine with antimicrobial peptides», Bull OIV 2002, 855-856: 284-302.
22 Mine, Y. y Zhang, J.W.: «Comparative studies on antogenity and allergenity of native and denatured egg white proteins», J. Agric. Food Chem. 2002; 50 : 2679-2683.
23 Radler, F.: «Possible use of nisin in winemaking. II. Experiments to control lactic acid bacteria in the production of wine», Am. J. Enol. Vitic. 1990; 41: 7-11.
24 Rojo-Bezares, B.; Sánez, Y.; Zarazaga, M.; Torres, C. y Ruiz-Larrea, F.: «Antimicrobial activity of nisin against Oenococcus oeni and other wine bacteria», Int. J. Food Microbiol. 2007; 116: 32-36.
25 Bauer, R.; Hannes, A.N. y Dicks, L.M.T.: «Pediocin PD-1 as a method to control growth of Oenococcus oeni in wine», Am. J. Enol. Vitic. 2003; 54: 86-91.
26 Bauer, R.; Chikindas, M.L. y Dicks, L.M.T.: «Purification, partial amino acid sequence and mode of action of pediocin PD-1, a bactericin produced by Pediococcus damnosus NCFB 1832», Int. J. Food Microbiol. 2005; 101: 17-27.
27 Sacchi, K.L.; Visón L. F. y Adams, D.O.: «A review of the effect of winemaking techniques on phenolic extraction in red wines», Am J Enol Vitic. 2005; 56: 197-205.
28 Vrhovsek, U.; Vanzo, A. y Nemanic, J.: «Effect of red wine maceration techniques on oligomeric and polymeric proanthocyanidins in wine, cv. Blaufränkisch», Vitis 2002; 41: 47-51.
29 Monagas, M.; Gómez-Cordovés, C. y Bartolomé, B.: «Evolution of polyphenols in red wines from Vitis vinifera L. during aging in the bottle. I. Anthocyanins and pyroanthocyanins», Eur. Food Res. Technol. 2005; 220: 607-614.
30 Monagas, M.; Bartolomé, B. yGómez-Cordovés, C.: «Evolution of polyphenols in red wines from Vitis vinifera L. during aging in the bottle. II. Non-anthocyanin phenolic compounds», Eur. Food Res. Technol. 2005; 220: 331-340.
31 Cavin, J.F.; Andioc, V.; Etievant, P.X. y Diviès, C.: «Ability of wine lactic acid bacteria to metabolize phenol carboxylic acids», Am. J. Enol. Vitic. 1993; 44: 76-80. v
32 Barthelmebs, L.; Diviès, C. y Cavin, J.F.: «Molecular characterization of the phenolic acid metabolism in the lactic acid bacteria Lactobacillus plantarum», Appl. Environ. Microbiol. 2001; 66: 3368-3375.
33 Gury, J.; Barthelmebs, L.; Tran, N.P.; Diviès, C. y Cavin, J.F.: «Clonning, deletion, and characterization of PadR, the transcriptional repressor of the phenolic acid decarboxylase-encoding padA gene of Lactobacillus plantarum», Appl. Envir. Microbiol. 2004; 70: 2146-2153.
34 Vaquero, I., Marcobal, A. y Muñoz, R.: «Tannase activity by lactic acid bacteria isolated from grape must and wine», Int. J. Food Microbiol 2004; 96: 199-204.
35 Alberto, M.R.; Gómez-Cordovés, C. y Manca de Nadra, M.C.: «Metabolism of gallic acid and catequin by Lactobacillus hilgardii from wine», J. Agric. Food Chem. 2004; 52: 6465-6469.
36 Hernández, T.; Estrella, I.; Carlavilla, D.; Martín-Álvarez, P.J. y Moreno-Arribas, M.V.: «Phenolic compounds in red wine subjected to industrial malolactic fermentation and ageing on lees», Anal. Chim. Acta 2006; 563: 116-125.
37 37. Hernández, T.; Estrella, I.; Pérez-Gordo, M.; Alegría, E.G.; Tenorio, C.; Ruiz-Larrrea, F.; Moreno-Arribas, M.V.: «Contribution of Oenococcus oeni and Lactobacillus plantarum to the non anthocyanin phenolic composición of red wine during malolactic fermentation», J. Agric. Food Chem. 2007; 55 (13): 5260-5266.
38 Reguant, C.; Bordons, A.; Arola, L. y Rozès, N.: «Influence of phenolic compounds on the physiology of Oenococcus oeni from wine», J. Appl. Microbiol. 2000; 88: 1065-1071.
39 Vivas, N.; Lonvaud-Funel, A. y Glories, Y.: «Effect of phenolic acids and anthocyanins on growth, viability and malolactic activity of a lactic acid bacterium», Food Microbiol. 1997; 14: 291-300.
40 Alberto, M.R.; Farias, M.E. y Manca de Nadra, M.C.: «Effect of gallic acid and catechin on Lactobacillus hilgardii 5w growth and metabolism of aorganic compounds», J. Agric. Food Chem. 2001; 49: 4359-4363.
41 Rozès, N. y Peres, C.: «Effects of phenolic compounds on the growth and the fatty acid composition of Lactobacillus plantarum», Appl. Microbiol. Biotechnol. 1998; 49: 108-111.
42 Rozès, N. ; Arola, L. y Bordons, A.: «Effect of phenolic compounds on the co-metabolism of citric acid and sugars by Oenococcus oeni from wine», Lett. Appl. Microbiol., 2003; 36: 337-341.
43 Campos, F.M.; Couto, J.A. y Hogg, T.A.: «Influence of phenolic acids on growth and inactivation of Oenococcus oeni and Lactobacillus hilgardii»; J. Appl. Microbiol. 2003; 94:167-174.
44 Salih, A.G.; Le Quéré, J.M. y Drilleau, J.F.: «Action des acides hydroxycinnamiques libres et estérifiés sur la croissance des bactéries lactiques», Sci. Aliments 2000; 20: 537-560.
45 Stead, D.: «The effect of hydroxycinnamic acids on the growth of wine-spoilage lactic acid bacteria», J. Appl. Bacteriol. 1993; 75 : 135-141.
46 Rauha, J-P.; Remes, S.; Heinonen, M., et al.: «Antimicrobial effects of Finnish plant extracts containing flavonoids and other phenolic compounds», Int. J. Food Microbiol. 2002; 56: 3-12.
47 Zhu, X.; Zhang, H. y Lo, R.: «Phenolic compounds from the leak extract of Artichoke (Cynara scolymus L.) and their antimicrobial activities», J. Agric. Food Chem. 2004; 52: 7272-7278.
48 Ezouberi, A.; Gadhi, C.A.; Fdil, N.; Benharref, A.; Jana, M. y Vanhaelen, M.J.: «Isolation and antimicrobial activity of two phenolic compounds from Pulicaria odora L.», Etnopharm 2005; 99:287-292.
49 Puupponen-Pimia, R.; Nohymek, C.; Meier, C., et al.: «Antimicrobial properties of phenolic compounds from berries», J. Appl. Microbiol. 2001; 90: 494-507.
50 Puupponen-Pimia, R.; Nohymek, C.; Hartmann-Schmidin, S. et al.: «Berry phenolics selectively inhibit the growth of instestinal pathogens», J. Appl. Microbiol. 2005; 98: 991-1000.
51 Papadopoulu, C.; Soulti, K. y Roussis, I.G.: «Potential antimicrobial activity of red and white wine pehnolic extracts against strains of Staphylococcus aureus, Escherichia coli and Candida albicans»; Food Technol. Biotechnol. 2005; 43: 41-46.
52 Baydar, N.G.; Ozkan, G. y Sagdic, O.: «Total phenolic contents and antibacterial activities of grape (Vitis vinifera L.) extracts», Food Control 2004; 15: 335-339.
53 Soleas, G.J.; Dam, J.; Carey, M. y Goldberg, D.M.: «Toward the fingerprinting of wines: cultivar-related patters of polyphenolic constituents in Ontario wines», J. Agric. Food. Chem. 1997; 45: 3871-3880.
54 De Villiers, A.; Majek, P.; Lynen, F.; Crouch, A.; Lauer, H. y Sandra, P.: «Classification of South African red and white wines according to grape variety based on the non-coloured phenolic content», Eur. Food Res. Technol. 2005; 221: 520-528.