Durante la fermentación alcohólica, las células de levadura se exponen progresivamente a un ambiente muy estresante debido al gran decrecimiento del pH externo y al aumento de acumulación de etanol en el medio exterior.1 Un ambiente así, induce progresivamente a una leve reducción de la viabilidad de la célula, relacionado con las alteraciones de la membrana plasmática celular, la cual, en condiciones de estrés, como por ejemplo, disminución de nutrientes y temperaturas de fermentación altas o bajas, podría llevar a una caída brusca de la viabilidad de la célula hasta cero, antes que la fermentación alcohólica se hubiese completado.2 Fermentaciones lentas y atascadas como éstas representan un riesgo para los enólogos, debido a que los azúcares residuales en vinos ya acabados, siempre representan ciertas inestabilidades microbiológicas y sensoriales.
Desde hace 25 años, la utilización de levaduras activas deshidratadas o secas (LAD) como iniciadoras para la producción de vino permite más fermentaciones alcohólicas reproducibles. Así pues, su uso no supera los riesgos de pérdida de viabilidad celular cuando se hallan en un ambiente en condiciones de estrés. La adición de nutrientes diversos (nitrógeno, vitaminas u oxígeno) durante la fermentación sólo podrá proteger parcialmente las células de levadura en estas condiciones estresantes.
Recientemente, se han obtenido resultados de investigaciones en la fisiología de la levadura durante la rehidratación de las LAD, que son una gran oportunidad para diseñar nuevos productos destinados a la mejora de la fermentación alcohólica en condiciones extremas. Este artículo presenta una visión general de los mencionados resultados y hace énfasis en sus potenciales impactos para los enólogos.
Nuevos estudios sobre la fisiología de las levaduras durante la rehidratación
Las levaduras activas deshidratadas (LAD) se obtienen industrialmente mediante el secado y granulación de la pasta de las levaduras hasta que los contenidos en agua lleguen a valores del 6 al 8 %.3 En este estricto paso de secado se induce una reducción del volumen celular interno.4 En estas condiciones, la LAD conserva una elevada viabilidad después del secado. Antes de usarse, la LAD necesita, pues, ser rehidratada con agua (generalmente a 37 ºC, durante 30 minutos). La fase de rehidratación es imprescindible para devolver el agua a los contenidos habituales del interior de las células (aproximadamente el 99 %). Dicho flujo de agua hacia el interior de las mismas, observado durante la rehidratación de las LAD, causa la elevada hinchazón de la célula y la rápida restauración de su viabilidad.5 Este es un prerrequisito para una buena aclimatación de las levaduras iniciadoras a las condiciones del mosto, y por lo tanto, a la restauración de la capacidad metabólica de fermentación.
Recientemente, hemos demostrado, usando sondas fluorescentes lipídicas orientadas hacia la membrana plasmática, que se produce simultáneamente una gran movilización de los lípidos durante la rehidratación, especialmente en los primeros 15 minutos.6 Así, durante la rehidratación, se observó al microscopio electrónico que, en efecto, se produce previamente una rápida movilización de los lípidos almacenados en el interior de las células. Esta movilización, permite a las células de levadura recuperar, también rápidamente, la funcionalidad de las membranas celulares.
Esteroles como factores clave en la membrana plasmática celular
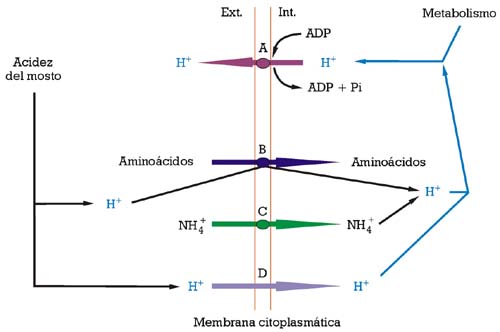
La membrana citoplasmática es la única barrera existente entre el citoplasma celular y el medio exterior. Dicha parte subcelular de la célula tiene un papel importante en la interficie, puesto que ayuda a la célula a luchar contra los efectos perjudiciales del etanol y de la acidez del mosto (fig. 1), la membrana plasmática está constituida mayoritariamente por una bicapa lipídica formada por un equilibrio de fluidos de diferentes clases de fosfolípidos, creando un ambiente marcadamente apolar que envuelve a la célula de la levadura. Por ella misma, dicha membrana no es fácilmente permeable a diferentes macromoléculas e iones, con la excepción de los protones (iones H+) (fig.1). Dicha arquitectura tan fluida se estabiliza mediante moléculas rígidas más pequeñas, los esteroles, que son los encargados de la estabilización de la membrana, mayoritariamente en aquellas regiones donde se hallan proteínas integrales importantes (transportadores). Por lo tanto, los esteroles ejercen un rol muy importante en la construcción y mantenimiento de las membranas de las levaduras: básicamente regulan la fluidez y permeabilidad de la membrana, y la actividad ATPasa de bombeo de protones. También regulan el ciclo celular, la expresión génica y la captación de esteroles exógenos (véase Daum et al).7
La acumulación de etanol en el medio, durante la fermentación alcohólica, interactúa intensamente con el funcionamiento de la membrana plasmática como interficie entre dicho medio y la parte interna de la célula. Sus principales efectos deletéreos son la pérdida de protones por la membrana plasmática y la inhibición parcial de la actividad enzimática ATPasa de bombeo de protones (fig. 2). Las células de levadura «se hallaban», por lo tanto, con la obligación de consumir más energía (en forma de ATP), para mantener la homeostasis del pH, hasta que el equilibrio entre la entrada pasiva de protones y su expulsión por la actividad ATPasa de bombeo de protones no pudiese sostenerse, llevando la célula hacia la muerte (fig. 2.2). El efecto tóxico del etanol se ve incrementado por temperaturas bajas (por debajo de los 8-10 ºC) e intermedias (en el intervalo de los 20-30 ºC), dependiendo de la concentración de etanol.8,9 Los esteroles de membrana tienen una función importante en estabilizar la membrana plasmática y en fortalecerla contra dicho efecto tóxico del etanol.2
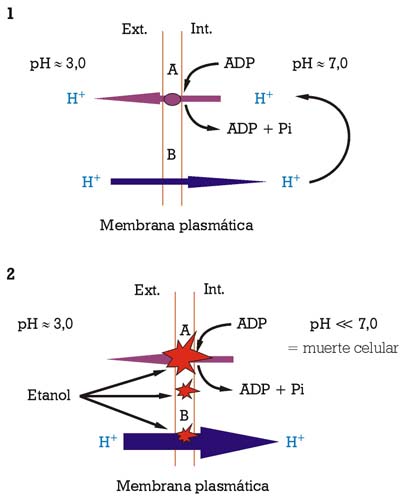
1) Mantenimiento de la homeostasis del pH mediante la actividad ATPasa de bombeo de protones.
2) Ruptura del equilibrio entre entradas pasivas de protones y su expulsión a través de la actividad ATPasa de bombeo de protones, conduciendo a la muerte celular.
A) actividad ATPasa de bombeo de protones; B) difusión libre de protones (iones H+) [Fuente: Salmon, 1998]9
Origen de los esteroles de membrana plasmática durante la fermentación alcohólica
En condiciones enológicas, las células de levadura sólo son capaces de sintetizar esteroles en presencia de pequeñas cantidades de oxígeno.10 En dichas condiciones, el esterol principal de la membrana plasmática es el ergosterol. En anaerobiosis completa, las levaduras no pueden sintetizar el ergosterol, pero pueden incorporar una gran variedad de esteroles exógenos.
Por ejemplo, durante la fermentación del vino, el crecimiento de las levaduras sucede asimilando los fitosteroles de la uva, que se hallan principalmente en la cera cuticular y en la piel de los granos de uva.11,12 Estos fitosteroles se extraen generalmente durante las fases de maceración.13 No obstante, estudios recientes han revelado que, en condiciones enológicas de ausencia de oxígeno, aunque la asimilación del fitosterol pueda sostener el crecimiento de las levaduras, las células de levadura correspondientes no pueden alcanzar fermentaciones alcohólicas completas sólo asimilando fitosteroles de la uva.14
Este efecto puede estar relacionado con las diferencias en las estructuras químicas del ergosterol y el fitosterol. El ergosterol posee papeles importantes según sea su concentración en las membranas de las levaduras.15 Pequeñas cantidades de ergosterol realizan un «brillante papel», iniciando el crecimiento de la célula. A elevadas concentraciones, cumple un «papel dominante», que representa la mínima cantidad de esterol requerido para el crecimiento activo y para la síntesis de membranas intactas. A mayor concentración, los esteroles se incorporan a las membranas como esteroles libres, realizando el papel de componentes arquitectónicos de las membranas. Esto continúa hasta que se alcanza la concentración correspondiente al papel modulador de las propiedades de membrana (denominado bulk role) como, por ejemplo, la máxima cantidad de esteroles que se pueden incorporar a las membranas.
Una amplia variedad de esteroles, incluyendo los fitosteroles, puede ejercer aparentemente este bulk role en las membranas de las levaduras. En condiciones enológicas, los mínimos requisitos de ergosterol para el máximo crecimiento anaeróbico de S. cerevisiae que se obtuvo fueron 0,1 µmol/10 células.9,10
A pesar de ello, muchos tratamientos prefermentativos, y mayoritariamente la clarificación, practicada a menudo en producción de vino blanco y rosado, comportan floculación de partículas y agregados pécticos, en los que los fitosteroles, que son compuestos muy hidrófobos, quedan absorbidos.16 Después de estos tratamientos prefermentativos, los mostos de uva podrían ver reducida en gran parte la concentración de esteroles asimilables al inicio de la fermentación alcohólica.
Suplementación de esteroles naturales durante la rehidratación
Así pues, en estas condiciones es imperativo ayudar a las células de las levaduras a recuperar una estructura óptima de las membranas de sus células para soportar una fermentación alcohólica eficiente. Para ello, utilizamos la propiedad de las células de levadura para movilizar sus reservas lipídicas durante la rehidratación de las LAD y recuperar rápidamente las membranas celulares funcionales.
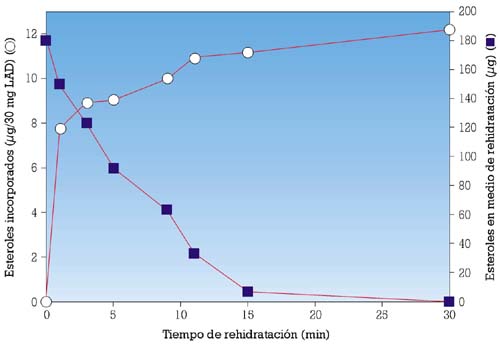
En un estudio previo, se había mostrado que, durante el proceso de rehidratación de la LAD, las células de levadura pueden incorporar fácilmente esteroles específicos aportados, de modo exógeno, por levaduras naturales durante la primera parte de la rehidratación (fig. 3), asimilando los esteroles a la forma de micelas.6
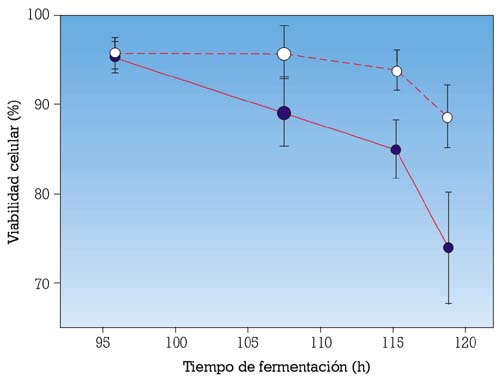
Esta primera complementación de las membranas de las levaduras con esteroles de levadura durante la rehidratación de la LAD, permite mantener la viabilidad de la célula, incluso más tarde, en el proceso de fermentación, cuando la concentración de etanol es máxima (fig. 4).
Esta aplicación de esterol durante la fase de rehidratación de la LAD está sustentada por una patente europea entre el INRA y Lallemand SAS (PCT 04-12309). La técnica correspondiente de rehidratación, ahora ha demostrado su eficacia en dos cosechas y en una gran variedad de condiciones extremas como el potencial alcohólico alto (mostos termovinificados), temperaturas difíciles (maceración de pellejo frío seguido de un largo reposo del mosto a baja temperatura), mostos alterados (mostos botritizados que no pueden soportar la microoxigenación durante la fermentación alcohólica), o simplemente mostos poco aireados y de baja turbidez.
Conclusiones
Los esteroles de la membrana plasmática tienen un papel importante en el mantenimiento de ésta como barrera de permeabilidad, especialmente al final de la fermentación alcohólica, cuando las condiciones ambientales llegan a ser perjudiciales para la célula, la rehidratación de la LAD es un paso tecnológico muy importante durante la elaboración del iniciador, desde la reconstrucción de las membranas de la célula y, consecuentemente, la capacidad metabólica que acontece durante esta breve fase.
El enriquecimiento de las levaduras activas deshidratadas con esteroles naturales durante su rehidratación es muy eficiente para completar la fermentación, cuando los mostos están limitados por la disponibilidad de los fitosteroles o cuando no se desea microoxigenación durante la fermentación. Eso representa una alternativa muy interesante para el abastecimiento de esteroles a las levaduras fermentativas, con el objetivo de sostener una gran viabilidad celular durante toda la fermentación alcohólica, especialmente en condiciones extremas, cuando las fermentaciones son proclives a convertirse en lentas y encalladas.
Bibliografía
1 Salmon, J.M.: «Sluggish and stuck fermentations: some actual trends on their physiological basis», Vitic Enol Sciences 1996; 51: 137-140.
2 Fornairon-Bonnefond, C., Demaretz, V., Rosenfeld, E., Salmon, J.M.: «Oxygen addition and sterol synthesis in Saccharomyces cerevisiae during enological fermentation», J Biosci Bioeng 2002; 93: 176-l 82.
3 Villetaz, J.C.: «Production industrielle des levures sèches de vinification». A: Donèche, B. (ed.). Les acquisitions récentes en microbiologie du vin: incidences sur lespropriétés organoleptiques et les altérations du vin, Technique et Documentation. Lavoisier, París, 1992: 71-78.
4 Beker, M.J., Blumbergs, J.E., Ventina, E.J., Rapoport, A.I.: «Characteristics of cellular membranes at rehydration of dehydrated yeast Saccharomyces cerevisiae», Appl Microbiol Biotechnol 1984; 19: 347-352.
5 Salmon, J.M., Ortiz-Julien A.: «Improvement of alcoholic fermentation in extreme conditions»,Bulletin OIV 2007; 914-916: 321-328.
6 Soubeyrand, V., Luparia, V., Williams, P., Doco, T., Vernhet A., Ortiz-Julien, A., Salmon, J.M.: «Improvement of the fermenting capacity of active dry yeast (ADY) by solubilized sterols during rehydration», J Agric Food Sci2005; 53: 8025- 8032.
7 Daum, G., Lees, N.D., Bard, M., Dickson, R.: «Biochemistry, cell biology and molecular biology of lipids of Saccharomyces cerevisiae», Yeast 1998; 14: 1471-1510.
8 Sa-Correia, I., Van Uden, N.: «Ethanol-induced death of Saccharomyces cerevisiae at low and intermediate growth temperatures», Biotechnol Bioeng 1986; 28: 301-303.
9 Salmon, J.M. «Relations levure-milieu». A: Flanzy C. (ed.). Œnologie – fondements scientifiques et technologiques, Technique et Documentation. Lavoisier, París, 1998: 415-444.
10 Rosenfeld, E., Beauvoit, B., Blondin, B., Salmon, J.M.: «Oxygen consumption by anaerobic Saccharomyces cerevisiae under enological conditions: effect on fermentation kinetics», Appl Environ Microbiol 2003; 69: 113-121.
11 Higgins, P.A., Peng, A.C. «Lipid composition of Concord grapes». Am J Enol Vitic 1976; 27: 32-35.
12 Le Fur, Y., Hory, C., Bard, M.H., Olsson, A.: «Evolution of phytosterols in Chardonnay grape berry skins during last stages of ripening», Vitis 1994; 33: 127-131.
13 Valero, E., Millan, M.C., Mauricio, J.C., Ortega, J.M.: «Effect of grape skin maceration on sterol, phospholipid, and fatty acid contents of Saccharomyces cerevisiae during alcoholic fermentation», Am J Enol Vitic 1998; 49: 119-124.
14 Luparia, V., Soubeyrand, V., Berges, T., Julien, A., Salmon, J.M. «Assimilation of grape phytosterols by Saccharomyces cerevisiae and their impact on enological fermentations», Appl Microbiol Biotechnol 2004; 65: 25-32.
15 Rodríguez, R.J., Low, C., Bottema, C., Parks, L.W.: «Multiple functions for sterols in Saccharomyces cerevisiae», Biochim Biophys Acta 1985; 837: 336-343.
16 Cocito, C., Delfini, C.: «Experiments for developing selective clarification techniques: sterol and fatty acid loss from grape must related to clarification technique», J Wine Res 1997; 8: 187-197.






