Introducción
La fermentación maloláctica (FML) se desarrolla inoculada o no de forma habitual en vinos tintos; sin embargo, es más infrecuente en vinos blancos y rosados. Aunque en ocasiones sucede, incluso de forma indeseada, restando acidez y por tanto frescor a los vinos. En la actualidad, y quizás debido a consecuencias del cambio climático como la elevación del pH en los vinos, aumenta la frecuencia de estas FML indeseadas. Se pueden desarrollar distintas estrategias para evitar la FML no deseada.1 Entre ellas su control mediante aditivos bactericidas o bacteriostáticos, o el uso de técnicas físicas no térmicas (tabla 1).
En este trabajo se van a evaluar las ventajas del empleo de dos aditivos altamente efectivos en la inhibición de la FML: el quitosano y el ácido fumárico. Del primero está permitido su uso en vinos como clarificante,2 aunque como efecto colateral tiene una alta capacidad para bloquear el desarrollo de la FML.3 El segundo aceptado como acidificante y saborizante en el Codex alimentarius FAO-WHO en alimentos,4 y su capacidad inhibitoria sobre la FML en vinos se conoce desde los años setenta del siglo pasado.5
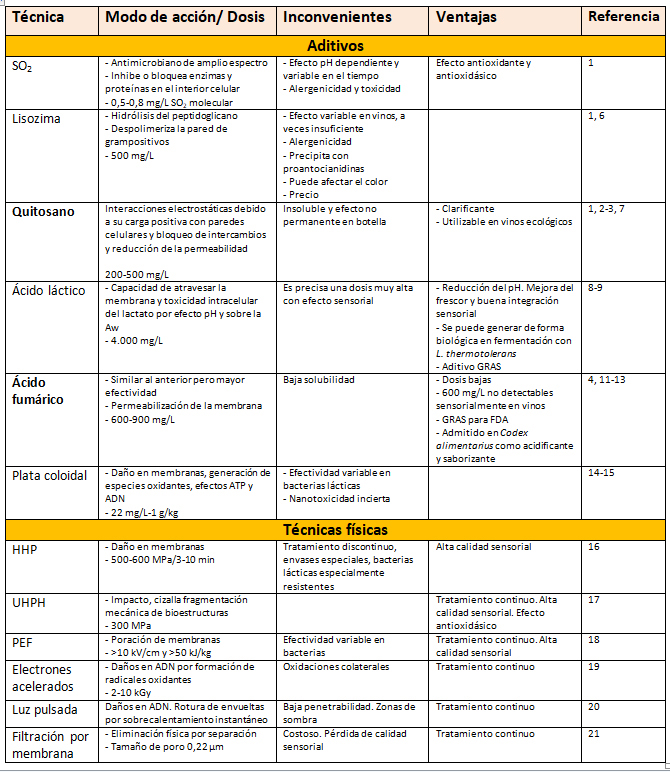
HHP: altas presiones hidrostáticas; PEF: campos eléctricos pulsados; UHPH: ultrahomogeneización a alta presión
El quitosano es un polisacárido (β-1, 4-D-glucosamina parcialmente desacetilada) con densidad de carga positiva e insoluble (fig. 1). Se produce por desacetilación de la quitina que se puede obtener del exoesqueleto de crustáceos o de origen fúngico.7
Varias empresas producen quitosano de origen fúngico para ser utilizado como clarificante y antimicrobiano y es de uso ecológico.22 El quitosano es insoluble, se mezcla con agua o una fracción de vino, se homogeneiza con el total y luego se retira una vez realizada la clarificación coloidal; se recomiendan periodos de contacto de unos 10 días.22 En este proceso se retiran microorganismos entre los que pueden estar bacterias lácticas, acéticas y levaduras alterantes como Brettanomyces.
El ácido fumárico (ácido trans-butenodioico; CAS# 110-17-8; PM 116,07 g/mol) es un sólido blanco poco soluble en agua y fácilmente analizable por LC-DAD por su alta respuesta en el UV debido al doble enlace. Dosis de hasta 600 mg/L de ácido fumárico no se detectan sensorialmente en pruebas triangulares.13 En ensayos de preferencia se observa en los vinos tratados con ácido fumárico una mayor acidez, un ligero efecto en el cuerpo, y en tintos un color más intenso por la modificación del pH.13
El efecto de quitosano y ácido fumárico es complementario, ya que el ácido fumárico aporta persistencia y protección postratamiento en botella, mientras que el del quitosano termina una vez se retira el clarificante.
Metodología
Para los ensayos de inhibición se ha usado la cepa Uvaferm Alpha® (Lallemand Inc., Montreal, CA) de Oenococcus oeni. Esta cepa es tolerante a: pH > 3,2; etanol < 15,5 % v/v; total SO2 < 50 mg/L; temperatura > 14 °C. Tiene requerimientos nutricionales normales, buena implantación rápida cinética fermentativa y baja producción de acidez volátil y aminas biógenas.
Los inóculos se han preparado en medio MLO (Pronadisa, Madrid, España) suplementado con un 10 % de zumo de tomate a 30 °C. La población se ha estimado por DO a 600 nm y verificado por plaqueo en profundidad en medio MLO. La población inicial en el vino inoculado de 7-log UFC/mL en el ensayo de inhibición en el que se evaluaron de forma independiente el ácido fumárico y el quitosano, y de 8-log en el ensayo de inhibición en que ambos se usaron de forma conjunta.
«El ácido fumárico se ha añadido a distintas concentraciones a partir de una disolución de 10 g/L. El quitosano se ha añadido dispersado en vino.»
Ácido fumárico (99,0 %) (Panreac, Barcelona, España), y quitosano Bactiless™ (Lallemand Inc., Montreal). El ácido fumárico se ha añadido a distintas concentraciones a partir de una disolución de 10 g/L. El quitosano se ha añadido dispersado en vino.
La evolución del ácido málico se ha determinado por análisis enzimático. Se ha empleado un autoanalizador enzimático mod Y15 (Biosystems, Barcelona, España).
Las FML se han desarrollado en vino tinto de la de la variedad tempranillo (V. vinifera L). Sus parámetros analíticos son: etanol (%, v/v) 12, pH 3,8, azúcares residuales <2 g/L. Se ha tratado térmicamente 10 min a 110 °C. Se ha comprobado la ausencia de bacterias viables en 10 mL. Los ensayos de inhibición de la FML se han realizado en volúmenes de 60 mL. Se ha mantenido un control sin inocular que no ha desarrollado la FML.
Resultados y discusión
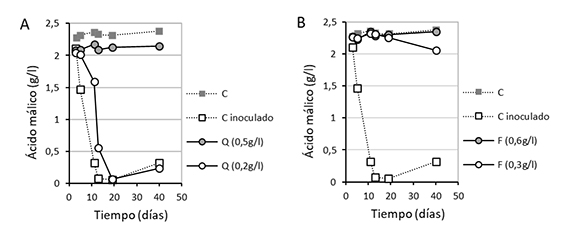
En el vino con población 7-log de Oenococcus oeni (Oo), la dosis de quitosano de 0,2 g/L es insuficiente para detener la FML; sin embargo 0,5 g/L bloquean completamente la degradación de málico (fig. 2A). La ausencia de FML se mantiene durante más de 40 días. Hay que considerar que la población que se inocula es la de una FML vigorosa en pleno desarrollo, no una población residual que pudiera existir en un vino. En cambio, cuando se añade ácido fumárico a dosis de 0,3 y 0,6 ambas inhiben (fig. 2B). Ya se ha observado el efecto inhibitorio de dosis de fumárico de 0,3 a 0,6 g/L.13 Aunque en algunos casos 0,3 puede ser insuficiente dependiendo de la dosis de inóculo, de la composición nutricional del mosto, pH y T.
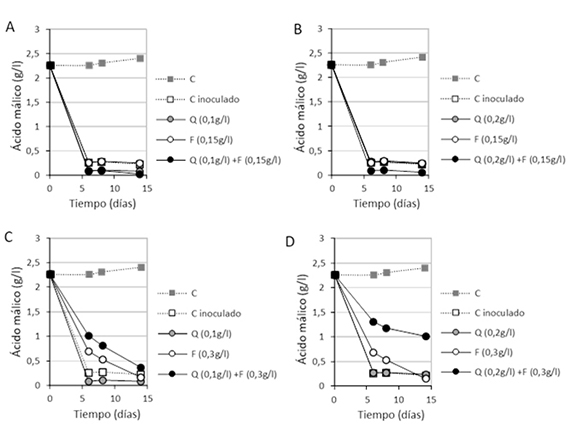
Para comprobar el efecto conjunto de ambos inhibidores se ha hecho un segundo experimento aplicando diversas dosis de quitosano y ácido fumárico. En este experimento la dosis inoculada inicial de Oo ha sido de 8-log UFC/mL. En las figuras 3A y B se verifica que a dosis de ácido fumárico de 0,15 g/L y de quitosano de 0,1 y 0,2 g/L, no existe inhibición de la FML y se completan entre 5 y 15 días, cuando se adicionan de forma individual y conjunta. Por tanto, estas dosis no tienen efecto inhibitorio en las condiciones y vino estudiados. Previamente se ha observado que una dosis de 0,15 g/L de ácido fumárico no tiene una concentración adecuada para detener la FML.13 Dependiendo de las condiciones retrasa, pero no produce una inhibición siquiera parcial de la FML.
Sin embargo, cuando se utilizan las mismas dosis de quitosano pero con 0,3 g/L de ácido fumárico, los tratamientos individuales no resultan inhibitorios (figs. 3C y D), aunque la dosis de 0,3 g/L ralentiza el desarrollo de la FML (figs. 3C y D). Sin embargo, ambos tratamientos conjuntos muestran un mayor efecto inhibitorio (fig. 3C) y el de 0,2 g/L de quitosano con 0,3 de fumárico detiene la FML después de 5 días (fig. 3D), mostrando un efecto sinérgico. Pese a la alta población inicial inoculada (8-log UFC/mL), la degradación de málico es solo ligeramente superior al 50% (fig. 3D).
El empleo de dosis reducidas de ambos inhibidores permite retrasar y/o detener la FML al aplicar quitosano complementado con el ácido fumárico. Además, existe un efecto protector residual por el fumárico que permanece en disolución incluso post embotellado. La inhibición de la FML además incide en la reducción de metabolitos fermentativos bacterianos potencialmente tóxicos como las aminas biógenas y en la reducción de los niveles necesarios de SO2. Colateralmente, debido al efecto acidificante del ácido fumárico se aumentan los niveles de SO2 libre y molecular y se intensifica el color en vinos tintos por efecto hipercrómico.13,23 El efecto acidificante del ácido fumárico es 1,5 veces el del ácido cítrico24, y se consiguen reducciones de pH de 0,1-0,2 unidades dependiendo del efecto tampón del vino cuando se utilizan dosis de 300-600 mg/L.
La apolaridad del ácido fumárico, debido a su doble enlace, hace que se comporte como anfipático, y sea más eficiente atravesando estructuras lipídicas como la membrana celular bacteriana. Por esto es más fácil que concentraciones más altas permeen al interior celular y muestre una mayor actividad antimicrobiana que otros ácidos como el láctico. Por otra parte no es inhibitorio frente a levaduras probablemente por metabolizarse intracelularmente.
Consideraciones finales
Quitosano y ácido fumárico son dos aditivos inocuos, que permiten controlar el desarrollo de bacterias lácticas y estabilizar los vinos frente a la FML. Su uso simultáneo tiene efectos complementarios y ligeramente sinérgicos. Constituyen una alternativa interesante y más eficaz que la lisozima para evitar pérdidas de acidez y frescura en los vinos por desarrollo indeseado de la FML. El ácido fumárico además tiene un ligero efecto acidificante a las dosis que se recomiendan como inhibidor de la FML. Dosis de hasta 600 mg/L de ácido fumárico son difíciles de detectar sensorialmente.
Agradecimientos
Ministerio de Ciencia, Innovación y Universidades project: [RTI2018-096626-B-I00]; European Regional Development Fund (ERDF) [FEDER INTERCONECTA EXP-00111498/ITC-20181125]- Proyecto FRESHWINES.
Bibliografía
1. Giacosa S, Río Segade S, Cagnasso E, Caudana A, Rolle L, Gerbi V. SO2 in wines: Rational use and possible alternatives. En: Red Wine Technology. Antonio Morata (ed.). Amsterdam: Elsevier, 2019; Ch. 21. p. 309-21.
2. OIV, 2017. Fining using chitosan. International Code of Oenological Practices 2017 Issue. Organisation Internationale de la Vigne et du Vin, Paris, France.
3. Bağder Elmacı S, Gülgör, G, Tokatlı M, Erten H, İşci A, Özçelik F. Effectiveness of chitosan against wine-related microorganisms. Antonie van Leeuwenhoek 2015; 107: 675-86. https://doi.org/10.1007/s10482-014-0362-6.
4. Véase http://www.fao.org/fileadmin/user_upload/jecfa_additives/docs/Monograph1/Additive-197.pdf.
5. Pilone GJ, Rankine BC, Pilone DA. Inhibiting malo-lactic fermentation in ustralian dry red wines by adding fumaric acid. American Journal of Enology and Viticulture 1974; 25: 99-107.
6. Bartowsky EJ. Bacterial spoilage of wine and approaches to minimize it. Letters in applied microbiology 2009; 48: 149-56. https://doi.org/10.1111/j.1472-765X.2008.02505.x.
7. Morata A. Polisacáridos con actividad biológica. Quitosán. En: Nuevas tecnologías de conservación de alimentos. Antonio Morata, ed. Madrid: AMVEdiciones, 2010, cap. 21, p. 306-15.
8. Shelef LA. Antimicrobial effects of lactates: A review. Journal of Food Protection 1994; 57: 445-50.
9. Morata A, Loira I, Tesfaye W, Bañuelos MA, González C, Suárez Lepe JA. Lachancea thermotolerans applications in wine technology. Fermentation 2018; 4: 53. https://doi.org/10.3390/fermentation4030053.
10. Molatová Z, Skřivanová E, Macias B, Mcewan NR, Březina P, Marounek M. Susceptibility of Campylobacter jejuni to organic acids and monoacylglycerols. Folia Microbiol 2010; 55: 215-20. https://doi.org/10.1007/s12223-010-0031-8.
11. Tango CN, Mansur AR, Kim GH, Oh DH. Synergetic effect of combined fumaric acid and slightly acidic electrolysed water on the inactivation of food‐borne pathogens and extending the shelf life of fresh beef. Journal of applied Microbiology 2014; 117: 1709-20.
12. Nkufi Tango C, Rois Mansur A, Oh DH. Fumaric acid and slightly acidic electrolyzed water inactivate gram positive and gram negative foodborne pathogens. Microorganisms 2015; 3: 34-46. https://doi.org/10.3390/microorganisms3010034.
13. Morata A, Bañuelos MA, López C, Song C, Vejarano R, Loira I, Palomero F, Suárez Lepe JA. Use of fumaric acid to control pH and inhibit malolactic fermentation in wines. Food Additives & Contaminants: Part A 2019. https://doi.org/10.1080/19440049.2019.1684574.
14. van Hasselt P, Gashe BA, Ahmad J. Colloidal silver as an antimicrobial agent: fact or fiction? Journal of Wound Care 2004; 13: 154-5. https://doi.org/10.12968/jowc.2004.13.4.26606.
15. Izquierdo-Cañas PM, García-Romero E, Huertas-Nebreda B, Gómez-Alonso S. Colloidal silver complex as an alternative to sulphur dioxide in winemaking. Food Control 2012; 23: 73-81.
16. Morata A, Loira I, Vejarano R, Bañuelos MA, Sanz PD, Otero L, Suárez‐Lepe JA. Grape Processing by high hydrostatic pressure: effect on microbial populations, phenol extraction and wine quality. Food and Bioprocess Technology 2015; 8: 277-86.
17. Loira I, Morata A, Bañuelos MA, Puig‐Pujol A, Guamis B, González C, Suárez‐Lepe JA. Use of ultra‐high pressure homogenization processing in winemaking: control of microbial populations in grape musts and effects in sensory quality. Innovative Food Science and Emerging Technologies 2018; 50: 50-6.
18. Puértolas E, López N, Condón S, Álvarez I, Raso J. Potential applications of PEF to improve red wine quality. Trends in Food Science and Technologies 2010; 21: 247-55.
19. Morata A, Bañuelos MA, Tesfaye W, Loira I, Palomero F, Benito S, Callejo MJ, Villa A, González MC, Suárez-Lepe JA. Electron beam irradiation of wine grapes: Effect on microbial populations, phenol extraction and wine quality. Food and Bioprocess Technology 2015; 8: 1845-53.
20. Escott C, Vaquero C, del Fresno JM, Bañuelos MA, Loira I, Han SY, Bi Y, Morata A, Suárez-Lepe JA. Pulsed light effect in red grape quality and fermentation. Food and Bioprocess Technology 2017; 10: 1540-7.
21. Delfini C, Formica JV. Microbiological stabilization through filtration. En: Wine Microbiology: Science and Technology. Claudio Delfini y Joseph V. Formica, eds. Boca Ratón, Fl: CRC Press, 2001; p. 446.
22. Véase: https://www.lallemandwine.com/es/spain/productos/catalogo/quitosano-es/.
23. Morata A, López C, Tesfaye W, González C, Escott C. Anthocyanins as natural pigments in beverages. En: Value-added ingredients and enrichments of beverages. Alexandru Grumezescu y Alina Maria Holban, eds. Cambridge, MA: Academic Press; 2019; p. 383-428.
24. Xu Q, Li S, Huang H, Wen J. Key technologies for the industrial production of fumaric acid by fermentation. Biotechnology Advances 2012; 30: 1685-96.