Preparados de levadura seca inactiva (LSI)
Es generalmente reconocido que algunas técnicas enológicas basadas en el envejecimiento de los vinos con las lías puede mejorar la calidad y las propiedades organolépticas de los mismos (estabilidad del color, protección contra la degradación de aromas).1 Los principales responsables de esta mejora son los compuestos liberados durante la autolisis de las levaduras, principalmente péptidos, aminoácidos, esteroles y polisacáridos (manoproteínas). Sin embargo, este método de elaboración de los vinos es considerablemente lento y, por tanto, no está exento de riesgo microbiológico lo que puede perjudicar las características organolépticas y la calidad de los vinos. Por ello, en los últimos años está ganando interés el uso de preparaciones comerciales que incluyan en su composición productos procedentes de las levaduras. Este tipo de preparaciones se obtienen a partir de la levadura enológica Saccharomyces cerevisiae tras su inactivación térmica o enzimática, una vez que se ha crecido en medios concentrados y ricos en azúcares. Dependiendo del método de obtención, las preparaciones pueden clasificarse en cuatro tipos principales: a) levaduras inactivas, se obtienen por inactivación térmica y posterior secado; b) autolisados de levaduras, en los que además de la inactivación térmica hay un paso de incubación en el que se permite a los enzimas de la levadura ser liberados de las vacuolas y degradar parte del contenido intracelular; c) paredes o cortezas de levaduras, son insolubles y están formados exclusivamente por las paredes de levadura sin contenido citoplasmático, y d) extractos de levadura, que es el extracto soluble que se obtiene tras la degradación total del contenido citoplasmático.
De entre todas estas preparaciones, las manoproteínas, que son el principal constituyente de la pared de Saccharomyces cerevisiae (25-50% de peso seco) han sido extensivamente estudiadas para mejorar los procesos tecnológicos y las características sensoriales de los vinos. Su uso como aditivos enológicos durante la vinificación ha sido recientemente aprobado en la Unión Europea (EU Regulation 2165/2005 20 diciembre de 2005). Sin embargo la heterogeneidad de este grupo de compuestos en cuanto a su estructura y composición, y las diferencias en los procesos empleados para su obtención, hacen que muchas de las preparaciones comerciales a base de manoproteínas difieran considerablemente en peso molecular y en su composición química (porcentaje de azúcar, proteína, aminoácidos, etc.). Esto puede dar lugar a efectos muy diferentes en el vino dependiendo del tipo de preparado comercial empleado.
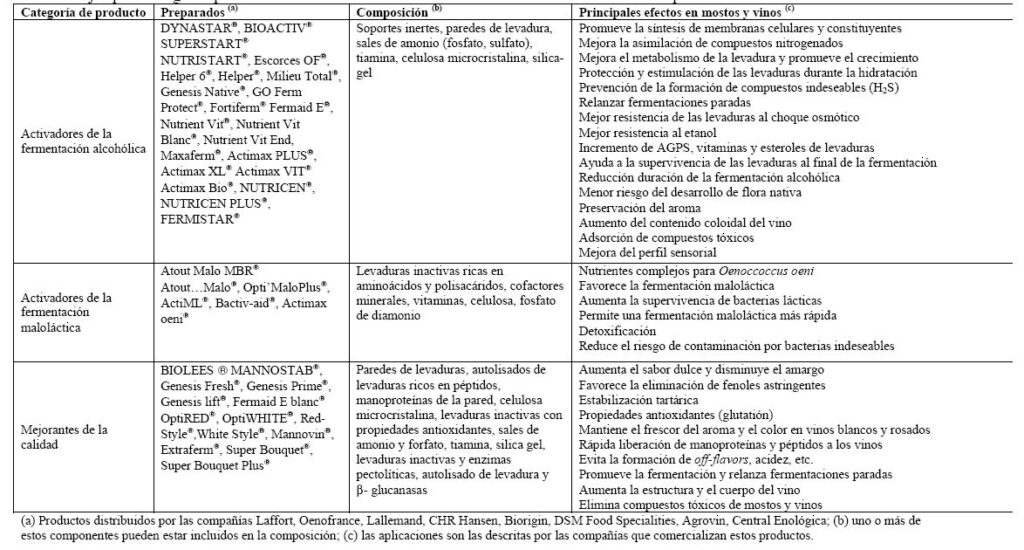
Además de las manoproteínas, también está autorizado el empleo de preparaciones celulares de levaduras, también conocidas como «paredes o cortezas de levaduras» (Reglamento CE n.º 479/2008), y en la actualidad diversos productos están accesibles comercialmente bajo esta clasificación. Otro tipo de preparados a base levaduras inactivas que se comercializan actualmente son preparaciones de composición muy variable, que suelen incorporar levaduras inactivas y metabolitos procedentes de la autolisis (proteína, péptidos aminoácidos nucleótidos, ácidos grasos) cuya concentración puede variar en función de las condiciones de cultivo;2 además suelen contener paredes de levaduras, vitaminas y minerales. Todos estos productos a los que, a lo largo de esta revisión, nos referiremos como preparados de levaduras secas inactivas (LSI), son actualmente suministrados por numerosas compañías biotecnológicas y/o enológicas, bajo diferentes marcas comerciales, para un amplio espectro de aplicaciones enológicas con el objetivo de mejorar la calidad de los vinos (tabla 1). Sin embargo, la información actual de que se dispone sobre este tipo de productos y sus mecanismos de acción durante la vinificación y en las sucesivas etapas de acabado de los vinos es muy escasa. Esto puede generar cierta confusión en los elaboradores sobre el tipo de preparación más adecuada para solventar un problema especifico, o sobre los mecanismos implicados en la mejora de las características organolépticas del vino.
A continuación se revisan las principales aplicaciones de estas preparaciones durante la vinificación y las evidencias científicas actuales sobre su modo de acción.
Principales aplicaciones de los preparados de LSI durante la vinificación
Efecto en la fermentación
La mejora de los procesos fermentativos mediante el empleo de LSI se basa en una acción indirecta gracias a su efecto protector durante la hidratación de las levaduras secas activas, o bien en un efecto directo de estimulación de la fermentación alcohólica y maloláctica.
Durante el proceso de hidratación de las levaduras secas activas, las células pueden experimentar modificaciones bioquímicas y cambios estructurales3 que pueden dañar las membrana celular. Se ha demostrado, que la rehidratación de las levaduras secas activas en presencia de una cantidad relativamente grande de LSI (100-200 g/L) aumenta la velocidad de fermentación y disminuye su duración.4 La liberación de fragmentos insolubles de las paredes de la levadura puede formar agrupaciones de esteroles en forma de micelas que se podrían incorporar en las membranas de las levaduras secas activas reparando sus posibles daños. En medios de fermentación sintéticos, se ha comprobado que la adición de 150 g/L de LSI añadidos durante la rehidratación sería equivalente a la adición de 40 µL/L de ergosterol en el medio de fermentación.5 Por otro lado, se ha sugerido que los ácidos grasos poliinsaturados (AGP) procedentes de las LSI podrían actuar como agentes protectores reduciendo el choque osmótico de las levaduras secas activas debido al elevado contenido de azúcares en el medio y favoreciendo la adaptación metabólica de las células a las nuevas condiciones.6,7
Aunque se ha sugerido que la consecuencia de este papel protector podría ser la reducción de la acidez volátil del vino y la formación de algunos aromas desagradables (SH2), este efecto nunca ha sido comprobado en los vinos. También se ha sugerido que los AGP liberados de las LSI podrían actuar como reservorios de micronutrientes que podrían ser transferidos a las nuevas generaciones de levaduras incrementando su resistencia y viabilidad. Sin embargo, este efecto no ha sido hasta el momento científicamente demostrado.
El empleo de preparados de LSI como activadores de las fermentaciones alcohólica y maloláctica es posiblemente la aplicación más común de este tipo de productos (tabla 1). Tanto las levaduras como las bacterias implicadas en la vinificación tienen requerimientos nitrogenados básicos. Saccharomyces cerevisiae puede utilizar como fuentes de nitrógeno en primer lugar el amonio (NH4+) y una vez consumidas las reservas de éste, también pueden utilizar a-aminoácidos de manera muy eficiente. Un bajo nivel de compuestos nitrogenados asimilables por las levaduras ha sido asociado con una disminución en la velocidad de fermentación y un detrimento en su eficacia, que son las principales causas de las paradas de fermentación.8 También el etanol y otros productos del metabolismo de las levaduras durante la fermentación, como los ácidos grasos de cadena corta y media, pueden contribuir a este fenómeno.
Para solventar estos problemas, se han venido utilizando diferentes tipos de fuentes de nitrógeno inorgánico, como las sales de amonio y la tiamina.9 Sin embargo, más recientemente se ha sugerido que el uso de preparados basados en LSI permite subsanar las carencias nutricionales y por tanto mejorar la fermentación. La diferente composición de este tipo de preparados comerciales, induce sin embargo diferentes efectos en la fermentación. La mayor parte de estas preparaciones pueden incluir una parte soluble, que incluye la mayoría de los metabolitos citoplasmáticos de la levadura (péptidos, proteínas, aminoácidos, ácidos grasos, etc.), una parte insoluble, formada por las paredes de la levadura y soportes inertes de tipo celulosa, además de otros compuestos como vitaminas, y minerales. Aunque se ha comprobado que la adición de activadores de la fermentación en medios sintéticos mejora el desarrollo de la fermentación alcohólica (mayor velocidad de fermentación, mayor número de células viables), el mecanismo de acción es muy diferente dependiendo de la composición del preparado. Por ejemplo, se ha comprobado que la adición de la fracción soluble de un preparado de LSI a un medio rico en nitrógeno asimilable (300 mg/L) no mejora la fermentación alcohólica,10 mientras que si la promueve en medios deficientes en nitrógeno (100 mg/L). Sin embargo, la adición de la fracción insoluble puede mejorar la eficiencia de la fermentación en medios ricos en nitrógeno debido al efecto detoxificante de las paredes de levadura, ya que son capaces de adsorber metabolitos tóxicos como los ácidos grasos de cadena corta.11 Se desconoce sin embargo, el efecto de estos preparados en condiciones de vinificación en bodega.
Otra de las razones que se han indicado para explicar el aumento en la eficacia de la fermentación tras la adición de preparados de LSI a los vinos, se debe al elevado contenido de esteroles presentes en las mismas. Larue et al.12 demostraron que el aumento del contenido de esteroles en las levaduras da lugar a una mayor eficiencia en la fermentación. Según los autores, esto produce una mayor permeabilidad en la membrana, lo que permite un mejor intercambio de sustancias entre la célula y el medio. El esterol acumulado en las membranas puede actuar además como un factor de supervivencia ya que podría ser utilizado por la levadura en la fase de declive. González-Marco et al.13 han comprobado en mostos Chardonnay suplementados con un autolisado de levadura, que el consumo de nitrógeno amínico aumenta durante la segunda mitad de la fermentación alcohólica comparado con el mosto control (sin adición del autolisado). Estos autores sugieren que los autolisados suplementan a los mostos con ácidos grasos de cadena larga (C16, C18) minimizando el daño en la membrana de la levadura y mejorando el transporte de membrana que de otra forma quedaría comprometido por el elevado contenido de etanol en el medio.
En los últimos años se está aumentando el empleo de preparados de LSI como activadores de la fermentación maloláctica. En este caso, los preparados se emplean, generalmente, una vez que la alcohólica ha sido completada. Al contrario que la fermentación alcohólica, la fermentación maloláctica suele ser un proceso más lento y en algunos casos se requieren incluso meses para completarla. Sin embargo, hasta que este proceso no se ha completado, no se pueden comenzar el resto de operaciones implicadas en la vinificación, lo que supone un riesgo de contaminación microbiana del vino, y la aparición de alteraciones organolépticas como el conocido «picado acético», la producción de fenoles volátiles14 o la formación de heterociclos nitrogenados volátiles,15 entre otras. La repercusión de estas alteraciones en la calidad del vino es una de las principales razones del uso de preparados de LSI. Sin embargo, y a pesar de su utilidad para la mejora de la fermentación maloláctica, en la mayoría de las ocasiones, el empleo de este tipo de preparaciones se esta realizando de una manera empírica debido a la falta de estudios científicos sobre el efecto de estos preparados en el metabolismo de las bacterias lácticas del vino y su modo de acción.16 Los primeros estudios sobre el tema indicaron que la adición de paredes de levaduras (0,2 g/L) a los vinos estimulaba el crecimiento de las bacterias lácticas durante la fermentación maloláctica,16 además de ejercer un efecto de detoxificación debido a su capacidad para la adsorción de sustancias tóxicas para la bacteria.17 La estimulación de la fermentación maloláctica por la adición de preparados de LSI, puede ser debida a la liberación de compuestos nitrogenados de la levadura (sobre todo amino ácidos y péptidos),2 ypolisacáridos y proteínas de la pared de la levadura.18,19 Algunos autores20 han comprobado, sin embargo, que sólo ciertas fuentes nitrogenadas estimulan la actividad proteásica de Oenococcus oeni. Por ejemplo, los péptidos de mayor tamaño (0,5-10 kDa) son más favorables para el crecimiento de bacterias del vino que los de menor tamaño (< 0,5 kDa). Además, esta capacidad es dependiente de la cepa bacteriana y de las condiciones de vinificación (pH, nivel de etanol, temperatura).
Además otros componentes de las levaduras, que se pueden encontrar en las preparaciones de LSI, como los lípidos, minerales, vitaminas, nucleótidos, etc., pueden tener también un importante papel en la estimulación de la fermentación maloláctica, aunque no hayan sido prácticamente estudiados.21
Por otro lado, la adición de preparados de LSI como activadores de fermentación alcohólica y maloláctica, podría inducir la aparición de cambios imprevisibles y negativos en la calidad del vino. Por ejemplo, se ha demostrado que los mostos suplementados con un autolisado de levadura tienen una mayor concentración de algunas aminas biógenas (tiramina y cadaverina) que proceden de los aminoácidos precursores tirosina y lisina, originalmente presentes en el autolisado de levadura (13).
Efecto en la composición y en las características organolépticas de los vinos
El empleo de preparados de LSI para la mejora de las características sensoriales de los vinos, es una de las aplicaciones que más interés ha despertado entre los elaboradores, aunque en la actualidad, los mecanismos implicados no están perfectamente elucidados. La mayor parte de los estudios científicos sobre este aspecto han sido realizados a pequeña escala, en condiciones muy diferentes a las de vinificación y casi siempre por las mismas compañías que comercializan este tipo de preparados. Es por ello, que en la actualidad, el uso de muchas de estas preparaciones se está realizando desde una aproximación empírica.
A continuación se revisarán los principales efectos de estas preparaciones en las propiedades sensoriales de los vinos y las evidencias científicas que lo apoyan.
- Efecto del glutatión en el color de los vinos blancos
Muchas de las preparaciones de LSI que se comercializan en la actualidad tienen como objetivo la mejora del color de los vinos blancos y tintos. En el caso de los vinos blancos, existen preparaciones que están indicadas para la disminución de los fenómenos de oxidación y de esta forma podrían actuar como protectores del color de estos vinos. En general este tipo de preparaciones son ricas en glutatión (GSH), un tripéptido intracelular de origen no proteico (L-γ-glutamil-L-cisteinil glicina). Este compuesto está originalmente presente en las uvas y mostos, de donde pasa al vino en el que se encuentra en concentraciones comprendidas entre 0,1 y 5,1 mg/L.22,23 Sin embargo, su evolución durante la vinificación o el papel que este compuesto ejerce durante la elaboración de los vinos no se conoce bien.
El contenido de GSH representa un 1% del peso seco de S. cerevisiae. El elevado contenido de glutatión de la célula de levadura junto con su bajo potencial redox (E’º = -240 mV at pH 7) hacen de este tripéptido un perfecto tampón redox. En S. cerevisie, GSH está implicado en innumerables mecanismos de estrés (falta de nitrógeno o azufre, estrés oxidativo, detoxificación de compuestos xenobióticos, etc.) y, además, juega un papel preponderante en el mantenimiento de la integridad celular.
Se ha comprobado que la adición de GSH (10 mg/L) antes del embotellado del vino puede reducir los fenómenos de oxidación, preservando el color y algunos compuestos del aroma varietal y disminuyendo a su vez, la formación de compuestos negativos para el aroma.24 Sin embargo, la eficacia del empleo de preparaciones de LSI ricas en glutatión no ha sido probada hasta el momento. Se desconoce por tanto, si la cantidad de glutatión liberada al vino podría ser capaz de provocar un efecto evidente en el mismo. Tampoco se conoce la dosis apropiada responsable de estos efectos deseados en el vino y la influencia de otras variables del proceso de vinificación, como el contenido de SO2, pH, etc. Además se ha comprobado que la cantidad de glutatión en un vino depende de la cepa de levadura empleada, lo que indicaría que las preparaciones de LSI podrían liberar diferente contenido de GSH en los vinos dependiendo de la cepa de levadura empleada en su producción industrial, lo que daría lugar a diferentes efectos en el vino.
- Efecto de los polisacáridos en el color y en la astringencia de los vinos tintos
La estabilidad del color en los vinos tintos envejecidos, depende al menos en parte, de la formación de pigmentos de tipo tanino-antocianina o antocianina-antocianina.24 Se ha comprobado, que la estabilidad del color en estos vinos puede mejorarse con el enriquecimiento del medio en polisacáridos. Estos compuestos podrían actuar como coloides protectores e interaccionar con los taninos y antocianinas previniendo así su agregación y precipitación y, por tanto, incrementando la estabilidad del color.25,26 En medios vínicos sintéticos, las manoproteínas de la levadura pueden evitar la agregación de taninos.25,27 Esta es la principal razón por la que se ha sugerido que el empleo de preparaciones de LSI puede estabilizar el color de los vinos tintos.9,28 Sin embargo, y al igual que ocurre con otras aplicaciones de este tipo de preparaciones, los trabajados encaminados a probar científicamente estos efectos son muy escasos. No obstante, recientemente, Guadalupe y colaboradores,29 comprobaron que la adición de un preparado de LSI rico en manoproteínas a mostos de la variedad Tempranillo (13,5 g/100 L) no provocaba ningún efecto en la estabilidad del color del vino, es decir, no inducía un estado coloidal de los polifenoles del vino. Estos autores, comprobaron además que estos vinos presentaban igual color o incluso menor que los vinos control (sin la adición de la preparación), lo que puede ser debido a la formación de un mayor número de complejos de tipo manoproteína-polifenol, provocando la precipitación de estos últimos. Estos estudios sugieren por tanto, la necesidad de profundizar en los mecanismos de actuación de estas preparaciones en los vinos y su relación con el color de los mismos.
Por otro lado, y relacionado con el empleo de preparaciones de LSI ricas en polisacáridos, una de las aplicaciones a las que más frecuentemente se hace referencia por parte de las compañías que comercializan estos productos, es su empleo para modular la astringencia de algunos vinos tintos así como para mejorar el cuerpo y la untuosidad del vino en boca. La astringencia de un vino, se debe a la capacidad de las procianidinas (o taninos condensados) de interaccionar con las proteínas de la saliva, lo que conduce a la formación de agregados que precipitan, disminuyendo o reduciendo la lubricación en la boca, y que son responsables de la sensación de sequedad en boca tras el consumo de algunos vinos ricos en taninos.
La capacidad de los polisacáridos de la levadura (manoproteínas) de interaccionar con las procianidinas del vino podría reducir su astringencia debido a la disminución de la cantidad de procianidinas libres capaces de interaccionar con las proteínas de la saliva.30 Por otro lado, el aumento en viscosidad debido a la presencia de polisacáridos de la levadura podría compensar la pérdida de lubricación producida por las procianidinas.30 Sin embargo, se ha comprobado que dependiendo de la composición de los polisacáridos, el efecto en la untuosidad es diferente.31
A pesar de que, como se ha comentado, se ha relacionado a los polisacáridos de las levaduras con una reducción en la astringencia, así como con el aumento del cuerpo y untuosidad de los vinos, tan sólo en un trabajo29 se ha comprobado que efectivamente la adición de un preparado de LSI rico en manoproteínas afectaba la estructura del vino, incrementando la sensación de dulzor y redondez y reduciendo su astringencia.
La adición simultánea de preparaciones de LSI junto con enzimas del tipo β-glucanasa, se ha propuesto también como procedimiento para aumentar el color del vino y la liberación de polisacáridos al mismo, y por tanto para disminuir su astringencia.28 Aunque tampoco en este caso hay suficientes evidencias científicas que puedan corroborar este efecto. Guadalupe et al.29 han comprobado que la adición al vino de una preparación a base de enzimas de maceración (poligalacturonidasas, pectinasas, etc.) aunque favorecía la extracción del color, aumentaba la astringencia y el contenido tánico del mismo. Estos resultados indican la necesidad de investigaciones adicionales para confirmar estos resultados.
- Otros efectos del empleo de preparaciones de LSI en las características organolépticas de los vinos
Las levaduras, y concretamente la pared celular tiene una gran capacidad de adsorber compuestos químicos del medio.32 Es importante tener en cuenta esta propiedad, ya que la adición de preparaciones de LSI (que contienen en su composición paredes de levadura), pueden provocar cambios sensoriales imprevistos en los vinos. Por ejemplo, se ha demostrado la capacidad de las paredes de las levaduras de adsorber compuestos de tipo antocianina33,34 y, por tanto, de modificar el color de los vinos tintos. También se ha comprobado su capacidad de adsorber otro tipo de compuestos fenólicos responsables del color y del pardeamiento de vinos blancos.35 Por otro lado, la capacidad de adsorción de algunos compuestos volátiles como los ácidos grasos de cadena corta por las paredes de levadura fue descrito por primera vez por Lafon-Lafourcade et al. en el año 1984 para la eliminación o reducción de este tipo de compuestos tóxicos para las levaduras.11 Desde entonces, la capacidad de adsorción de otros compuestos volátiles relevantes para el aroma de los vinos ha sido demostrada,36,37 y se ha comprobado la naturaleza hidrofóbica de estas interacciones y su dependencia de las características fisicoquímicas del compuesto. Recientemente, Chalier et al.38 han comprobado que las manoproteínas de levadura son capaces de retener compuestos del aroma, estando implicadas ambas partes de la molécula (glicosídica y peptídica) en la interacción. Además, encontraron diferencias importantes en al capacidad de retención de compuestos del aroma dependiendo de la cepa de levadura empleada.
También se ha comprobado la capacidad de las paredes de levadura de interaccionar con terpenos glicosilados,39 lo que puede tener consecuencias importantes para el aroma varietal de los vinos. Debido a la capacidad de las paredes de levadura de adsorber compuestos volátiles responsables de defectos aromáticos en el vino (fenoles volátiles), se ha propuesto también, la utilización de las paredes de levadura como método para eliminar o reducir la presencia de estos compuestos indeseables en el vino.40
Los efectos de la adición de preparados de LSI y sus consecuencias para el aroma del vino han sido estudiados por Comuzzo et al.41 Estos autores comprobaron la aparición en el vino de cambios sensoriales, positivos o negativos, dependiendo del tipo de vino y de sus características aromáticas iniciales.
Además del efecto de estas preparaciones en la reducción en volatilidad de los compuestos del aroma, en nuestro grupo de investigación hemos comprobado la capacidad de algunos compuestos volátiles presentes en estas preparaciones y originados durante su procesamiento (pirazinas) de ser liberados a los vinos, lo que podría implicar importantes cambios en el aroma vino.42
Efecto en la seguridad del vino
Los vinos, como otros muchos alimentos, pueden estar contaminados con ocratoxina A (OTA). Esta toxina es un potente neurotóxico y cancerígeno producida principalmente por hongos de las especies Aspegillus y Penicillium. El contenido de OTA en los vinos ha sido regulado en la Unión Europea a 2 µg OTA/L (EU Regulation 1881/2006, 19 de diciembre 2006). La búsqueda de metodologías que permitan la eliminación o la reducción del contenido de OTA en el vino es una línea de interés en la investigación actual en enología. Una de las estrategias más interesantes que actualmente se están evaluando para reducir el contenido de OTA, es el empleo de preparados de LSI. Por ejemplo, García-Moruno et al.43 han comprobado que la adición de 20 g/L de lías de levaduras (formadas principalmente por paredes de levadura) al vino, es capaz de reducir hasta un 70% el contenido de OTA después de 7 días. La competencia que existe entre polifenoles y OTA por los sitios de unión a las paredes de la levadura es la principal responsable de que esta estrategia sea más activa para reducir el contenido de OTA en vinos blancos que en vinos tintos.44 Las manoproteínas de la pared de las levaduras son las principales responsables de la unión de la OTA.45 Las diferencias en el contenido de manosilfosfato de las manoproteínas junto con otras características intrínsecas a la célula de levadura, como la velocidad de sedimentación, dimensión, capacidad de floculación, etc., pueden influir en la capacidad de adsorción de las manoproteínas.32 Además, otros parámetros de la vinificación, como la temperatura, pH, cantidad de etanol, así como la especie de levadura, pueden también modificar la capacidad de adsorción de la pared.
Otras sustancias tóxicas como ciertos metales pesados (plomo, cadmio), también pueden estar presentes como contaminantes en los vinos. Debido a sus efectos nocivos para la salud, el contenido de estos compuestos en el vino ha sido regulado por la OIV. Otros metales, como el hierro cuando su cantidad es excesiva (10-20 mg/L), puede disminuir la estabilidad del vino ya que en su forma reducida puede estar implicado en fenómenos de precipitación de pigmentos. El empleo de preparados de LSI podría ser una buena herramienta para la eliminación de metales pesados del vino. De hecho, Bornet et al.44 han comprobado que la adición a los vinos de quitina de origen fúngico, puede reducir el contenido de plomo y cadmio en el vino.
La capacidad de adsorción de compuestos químicos por las levaduras, puede extenderse a otras aplicaciones en los vinos para mejorar la seguridad de los mismos, como por ejemplo, su empleo para reducir el contenido de aminas biógenas, pesticidas y agentes antiespumantes.46 Aunque todas estas estrategias prometen resultados esperanzadores, sería necesario explorar el efecto de la adición de estas preparaciones teniendo en cuenta el efecto de todo los parámetros que participan en la vinificación (pH, SO2, etanol, etc.).
Conclusiones
En los últimos años el empleo de preparaciones a base de LSI ha aumentado en el sector enológico debido principalmente al gran número de posibles aplicaciones de estos productos para la mejora de los procesos tecnológicos y de las características sensoriales de los vinos. Es de prever que en los próximos años el número de aplicaciones siga aumentando y que estás sean más específicas. Por ejemplo, entre las aplicaciones más prometedoras está el empleo de preparados de LSI para estimular el crecimiento de bacterias lácticas y de la fermentación maloláctica en los vinos. Para ello será necesario elucidar el papel de los distintos componentes de los preparados de levadura en el crecimiento de las bacterias lácticas.
Por otro lado, la investigación encaminada hacia el empleo de estas preparaciones como método de biocontrol, para así mejorar la seguridad e higiene del vino, seguirá aumentando. Para ello se requiere un conocimiento más amplio de los mecanismos implicados y la obtención de preparaciones dirigidas, con aplicaciones específicas, pero sin provocar efectos colaterales (cambios sensoriales) en los vinos.47 Será además necesario realizar ensayos científicos en los que se consideren todos los factores implicados en la vinificación y el efecto de la adición de estas preparaciones en todas las etapas del proceso (maceración, inicio de fermentación, fermentación maloláctica, o durante el envejecimiento del vino).
En la actualidad, el empleo de este tipo de preparaciones en los vinos esta siendo debatido dentro la OIV, que reclama la necesidad de una mejor caracterización química de los diferentes tipos de preparaciones que existen en el mercado. Por tanto, es de prever que la investigación futura arrojará importantes resultados sobre la composición y caracterización química de estas preparaciones, su mecanismo de acción en el vino y sus efectos en la calidad sensorial. De esta forma se podrán establecer formulaciones de LSI apropiadas, dependiendo de los objetivos perseguidos y se podrán hacer recomendaciones a los elaboradores del tipo de preparación, así como de la dosis adecuada según el tipo de vino y las condiciones particulares de vinificación.
Bibliografía
1. Serradilla, J.A. & Luque de Castro, M.D. (2008). Role of lees in wine production: A review. Food Chemistry 111: 447-456.
2. Guilloux-Benatier, M., & Chassagne, D. (2003). Comparison of components released by fermented or active dried yeasts after aging on lees in a model wine. Journal of Agricultural and Food Chemistry 51: 746-751.
3. Beker, M.J., Blumbergs, E.J., Ventina, E.J. & Rapoport A.I. (1984). Characteristics of cellular membranes at rehydrated of rehydration of dehydrated yeast Saccharomyces cerevisiae. Applied Microbiology and Biotechnology 19: 347-352.
4. Dulau, L.A., Ortiz-Julien, A. & Trioli, G. (2002). Method for dry yeast rehydration and rehydration medium. International patent PCT/FR02/01949.
5. Soubeyrand, V., Luparia V., Williams, P., Doco, T., Vernhet, A., Ortiz-Julien, A., & Salmon, J.M. (2005). Formation of micelle containing solubilized sterols during rehydration of active dry yeasts improves their fermentation capacity. Journal of Agricultural and Food Chemistry 53: 8025-8032.
6. Caridi, A., Crucitti, P. & Ramondino, D. (1999). Winemaking of musts and high osmotic strength by thermotolerant yeasts. Biotechnology Letters 21: 617-620.
7. Caridi A. (2002). Protective agents used to reverse the metabolic changes induced in wines yeasts by concomitant osmotic and thermal stress. Letters in Applied Microbiology, 35, 98-1001.
8. Kunkee R.E. (1991). Relationship between nitrogen content of must and sluggish fermentation. In: Proceeding of the International Symposium on Nitrogen in Grapes and Wine, pp. 148-155.
9. Feuillat, M. (2001). Nouveaux adjuvants oenologiques possibles d’origine levurienne. Bulletin de l’OIV 849-850 : 753-771.
10. Feuillat, M & Guerreau, J. (1996). Les nouveaux activateurs de la fermentation alcoolique. Bulletin de l’OIV 789-790 : 987-998.
11. Lafon-Lafourcade S, Geneix C, & Ribéreau-Gayon P. (1984). Ways of initiating the action of yeast ghosts during winemaking. Connaissance de la Vigne et du Vin 18 : 111-125.
12. Larue F., Lafon-Lafourcade, S. & Ribéreau-Gayon P. (1980). Relationship between the sterol content of yeast cells and their fermentative activity in grape must. Applied and Environmental Microbiology 39: 808-811.
13. González-Marco, A., Jiménez-Moreno, N. & Ancín-Azpilicueta, C. (2006). Influence of addition of yeast autolysate on the formation of amines in wine. Journal of the Science of Food and Agriculture 86: 2221-2227.
14. Chatonnet, P., Dubourdieu, D., & Boidron, J.N. (1995). The influence of Brettanomyces/Dekkera sp yeasts and lactic acid bacteria on the ethylphenol content of red wines. American Journal of Enology and Viticulture 46: 463-468.
15. Costello, P.J., & Henschke, P.A. (2002). Mousy off-flavor of wine: Precursors and biosynthesis of the causative N-heterocycles 2-ethyltetrahydropyridine, 2-acetyltetrahydropyridine, and 2-acetyl-1-pyrroline by Lactobacillus hilgardii DSM 20176. Journal of Agricultural and Food Chemistry 50: 7079-7087.
16. Lonvaud-Funel, A., Desens, C., & Joyeux, A. (1985). Stimulation de la fermentation malolactique par l’addition au vin d’enveloppes cellulaires de levure et differents adjuvants de nature polysaccharidique et azotee. Connaissance de la Vigne et du Vin 19 : 229-240.
17. Edwards, C.G., & Beelman, R.B. (1987). Inhibition of the malolactic bacterium, Leuconostoc oenos (PSU-1), by decanoic acid and subsequent removal of the inhibition by yeast ghost. American Journal of Enology and Viticulture 38: 239-242.
18. Guilloux-Benatier, M., Guerreau, J., & Feuillat, M. (1995). Influence of initial colloid content on yeast macromolecule production and on the metabolism of wine microorganisms. American Journal of Enology and Viticulture 46: 486-492.
19. Guilloux-Benatier, M., Son, H.S., Bouhier, S., & Feuillat, M. (1993). Activités enzymatiques: glycosidases et peptidases chez Leuconostoc oenos au cours de la croissance bactérienne. Influence des macromolécules de levures. Vitis 32: 51-57.
20. Remize, F., Augagneur, Y., Guilloux-Benatier, M. & Guzzo, J. (2005). Effect of nitrogen limitation and nature of the feed upon Oenococcus oeni metabolism and extracellular protein production. Journal of Applied Microbiology 98: 652-661.
21. Alexandre, H., Costello, P.J., Remize F., Guzzo, J., & Guilloux-Benatier, M. (2004). Saccharomyces cerevisiae-Oenococcus oeni interactions in wine: current knowledge and perspectives. International Journal of Food Microbiology 26: 235-240.
22. Okuda, T. & Yokotsuka, K. (1999). Levels of glutathione and activities of related enzymes during ripening of Koshu and Cabernet Sauvignon grapes and during winemaking. American Journal of Enology and Viticulture 50: 264-270.
23. Park, S.K., Boulton, R.B., & Noble A.C. (2000). Automated HPLC analysis of glutathione and thiol-containing compounds in grape juice and wine using pre-column derivatization with fluorescence detection. Food Chemistry 68: 475-480.
24. Hayasaka, Y. & Kennedy, J.A (2003) Mass spectrometric evidence for the formation of pigmented polymers in red wines. Australian Journal of Grape and Wine Research 9: 210-220.
24. Lavigne-Cruege, V., Pons, A., Chone, X. & Dubourdieu, D. (2003) In: Oenologie, Lonvaud-Funel A., de Revel., G., Darriet Ph (Eds.), Editions Tec&Doc, Paris, 385-387.
25. Escot, S., Feuillat, M., Dulau, L., & Charpentier, C. (2001). Release of polysaccharides by yeasts and the influence of released polysaccharides on colour stability and wine astringency. Australian Journal of Grape and Wine Research 7: 153-159.
26. Doco, T., Patrick, V., Cheyner, V. & Moutonet, M. (2003) Structural modification of wine arabinogalactans during aging on lees. American Journal of Enology and Viticulture 54: 150-157.
27. Riou V., Vernhet, A., Doco, T. & Moutonet, M. (2002). Aggregation of grape seed tannins in model wine-effect of wine polysaccharides. Food Hydrocolloids 16: 17-23.
28. Francois, J.M., Alexandre H., Granes, D. & Feuillat, M. (2007). Vers une meilleure connaissance des produits dérivés de levures. Revue des Œnologues 122: 9-12.
29. Guadalupe, Z., Palacios, A. & Ayestarán, B. (2007). Maceration enzymes and mannoproteins: a possible strategy to increase colloidal stability and color extraction in red wines. Journal of Agricultural and Food Chemistry 55: 4854-4862.
30. Smith, A.K. & Noble, A.C. (1998). Effects of increased viscosity on the sourness and astringency of aluminium sulphate and citric acid. Food Quality and Preference 9: 139-144.
31. Vidal S., Francis L., Williams, P., Kwiatkowskia, M., Gawela, R., Cheynier, V. & Waters E. (2004). The mouth-feel properties of polysaccharides and anthocyanins in a wine like medium. Food Chemistry 85 : 519-525.
32. Caridi A. (2007). New perspectives in safety and quality enhancement of wine through selection of yeasts based on the parietal adsorption activity. International Journal of Food Microbiology 120: 167-172.
33.Morata, A., Gómez-Cordovés, M.C., Colomo, B., & Suárez, J.A. (2005). Cell wall anthocyanin adsorption by different Saccharomyces strains during the fermentation of Vitis vinifera L. cv Graciano grapes. European Food Research & Technology 220: 341-346.
34. Morata, A., Gómez-Cordovés, M.C., Suberviola, J.; Bartolomé, B., Colomo, B., & Suárez, J.A. (2003). Adsorption of anthocynins by yeast cell walls during the fermentation of red wines. Journal of Agricultural and Food Chemistry 51: 6475-6481
35. Razmkhab S., López-Toledano, A., Ortega, J.M., Mayen M., Merida, J., & Medina, M. (2002). Adsorption of phenolic compounds and browning products in white wines by yeasts and their cell walls. Journal of Agricultural and Food Chemistry 50: 7432-7437.
36. Lubbers, S., Charpentier, C., Feuillat M., & Voilley, A. (1994a). Influence of yeast walls on the behaviour of aroma compounds in a model wine. American Journal of Enology and Viticulture 45: 29-33.
37. Lubbers, S., Voilley, A., Feuillat, M., & Charpentier, C. (1994b). Influence of mannoproteins from yeast on the aroma intensity of a model wine. Food Science and Technology-Lebensmittel-Wissenschaft & Technologie 27: 108-114.
38. Chalier, P, Angot, B, Delteil, D. , Doco, T. & Gunata, Z. (2007). Interactions between aroma compounds and whole mannoprotein isolated from Saccharomyces cerevisiae strains. Food Chemistry 100: 22-30.
39. Moio, L., Ugliano, M., Gambuti, A., Genovese, A., & Piombino, P. (2004). Influence of clarification treatment on concentrations of selected free varietal aroma compounds and glycoconjugates in Falanghina (Vitis vinifera L.) must and wine. American Journal of Enology and Viticultu 55: 7-12.
40. Chassagne, D, Guilloux-Benatier, M, Alexandre, H. & Voilley, A. (2005). Sorption of wine volatile phenols by yeast lees. Food Chemistr 91: 39-44.
41. Comuzzo, P., Tat, L., Tonizzo, A., & Battistutta, F. (2006). Yeast derivatives (extracts and autolysates) in winemaking: Release of volatile compounds and effects on wine aroma volatility. Food Chemistry 99: 217-230.
42. Pozo-Bayón, M.A.; Andujar-Ortiz, I. & Moreno-Arribas, M.V. (2009). Volatile profile and potential of inactive dry yeast based winemaking additives to modify the volatile composition of wines. Journal of the Science of Food and Agriculture (en prensa, DOI 10.1002/jsfa.3638).
43. García-Moruno, E., Sanlorenzo, C., Boccaccino, B., & Di Stefano, R. (2005). Treatment with yeasts to reduce the concentration of ochratoxin A in red wines. American Journal of Enology and Viticulture 56: 73-76.
44. Bornet A., & Teissedre & P.L. (2008). Chitosan, chitin-glucan and chitin effects on minerals (iron, lead, cadmium) and organic (ochratoxin A) contaminants in wines. European Food Research & Technology 226: 681-689.
45. Ringot, D., Lerzy, B., Bonhoure, J.P., Auclair, E., Oriol, E. & Larondelle, Y. (2005). Effect of temperature on in vitro ochratoxin A biosorption onto yeast cell wall derivatives. Process Biochemistry 40: 3008-3016.
46. Pozo-Bayón, M.A.; Monagas, M.; Bartolomé, B. & Moreno-Arribas, M.V. Wine features related to safety and consumer health: an integrated perspective Crit Rev Food Sci Nutr (en prensa).
47. Pozo-Bayón, M.A.; Andujar-Ortiz, I. & Moreno-Arribas, M.V. (2009) Scientific evidences beyond the application of specific inactive dry yeast preparations in winemaking. Food Research International 42: 754-757.