Los tioles varietales y particularmente la 4-mercapto-4-metilpentan-2-ona (4MMP), el acetato de 3-mercaptohexilo (3MHA) y el 3-mercaptohexan-1-ol (3MH) han sido identificados como compuestos claves en el aroma de los vinos jóvenes procedentes de diversas variedades (fig. 1).
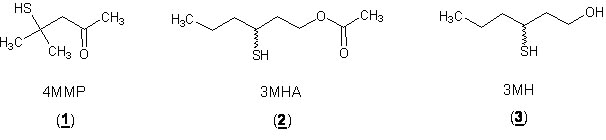
La contribución de estos compuestos al aroma del vino ha sido destacada por Du Plessis y Augustyn1 quienes han demostrado que el aroma de guayaba en los vinos sudafricanos de sauvignon se debió principalmente a la presencia de 4MMP. A diferencia de otros compuestos azufrados tales como el disulfuro de carbono, el etanotiol, el metanotiol o el sulfuro de hidrógeno producidos en altas concentraciones durante la fermentación alcohólica y responsables de defectos olfativos, los tioles varietales se encuentran en algunos vinos de Vitis vinifera en cantidades traza. Tienen olores agradables a brotes de casis, maracuyá y pomelo.
En los últimos 20 años, el interés de los científicos y de los técnicos por estos compuestos ha crecido mucho. Este artículo pretende dar una actualización sobre las vías de biosíntesis y el efecto de algunas técnicas vitivinícolas sobe el contenido de los vinos.
v
Los tioles varietales: aparición y contribución sensorial
La 4MMP fue formalmente identificada por primera vez en vinos de sauvignon blanc2-5 después en los de scheurebe,5 macabeo,6 gewürztraminer, riesling, muscat, colombard, manseng petit y tokay.7,8
Los 3MH y 3MHA son más ubicuos que la 4MMP ya que se encuentran en una amplia gama de vinos varietales tales como sauvignon blanc,9,10 petite arvine,11 petit y gros manseng,8,12 melon B. y bacchus,13 sémillon,8 verdejo,14 pero también en las variedades rojas tales como grenache,15 merlot y cabernet sauvignon16,17 y los vinos rosados de Provenza.18
La 4MMP tiene olor a boj y a brote de casis2-4 y está a menudo presente en concentraciones inferiores a 70 ng/L. Su umbral de detección olfativa es de 0,8 ng/L en solución hidroalcohólica.8 El 3MH y 3MHA, que son más abundantes, dan al los vinos blancos y rosados notas frutales de maracuyá y de pomelo.8,12,19 Sus umbrales de olor esta respectivamente en 60 y 4 ng/L.8 Hay que añadir que se considera el 3MH como responsable de aromas de casís en algunos vinos.20
La cromatografía de gas acoplada a la olfatometría (GC-O) es un método interesante para seleccionar moléculas activas en el perfil sensorial de los vinos. Esta técnica, que usa la nariz humana como detector, permitió la identificación de la 4MMP en los vinos de sauvignon blanc.2 Asociado con técnicas de dilución (AEDA – Aroma Extract Dilution Analysis), la GC-O ha permitido identificar la 4MMP como el compuesto de mayor contribución en el aroma de los vinos de Scheurebe.21 Estudios similares han demostrado el papel central del 3MH en el aroma de los vinos de Sauternes.22 En paralelo con los experimentos olfatometría, el ratio de la concentración de un compuesto sobre su umbral de olor puede ayudar a determinar las moléculas más olorosas en el vino. Este enfoque ha permitido poner de relieve la contribución de los tres tioles varietales en el aroma de viejos vinos españoles,24 mientras que el 3MHA es uno de los compuestos aromáticos más olorosos en los vinos de marmajuelo y de verdello.24
Sin embargo, el GC-O no tiene en cuenta los efectos de interacción entre los compuestos volátiles y entre la matriz. Para llenar este vacío, se han desarrollado experimentos de reconstitución de aroma. Esta es la mejor manera de medir la contribución de las interacciones con el aroma del vino. Una estrategia basada en el impacto cualitativo y cuantitativo de los compuestos olorosos, seguido de pruebas de omisión ha demostrado que el 3MH es un compuesto clave en los vinos rosados de Ggrnacha.15 Análisis sensorial y químico realizados en paralelo pueden, en situaciones sencillas, ayudar a establecer el vínculo entre los compuestos de aroma y las sensaciones olfativas, como se demostró recientemente en Nueva Zelanda donde los niveles de 3MH y 3MHA permiten predecir el carácter «frutas tropicales» de los vinos de sauvignon.25 Para otras sensaciones, la predicción es más difícil, incluso para los vinos sauvignon, como en el caso del carácter vegetal donde varios compuestos interactúan (2-isobutil-3-metoxipirazina, compuestos C6, 4MMP), y especialmente, porque que se intenta relacionarlo a las preferencias del consumidor.26,27
v
Las vías de biogénesis en los vinos
La 4MMP, el 3MH y el 3MHA son aromas varietales liberados durante la fermentación, a partir de precursores inodoros presentes en las uvas y los mostos.
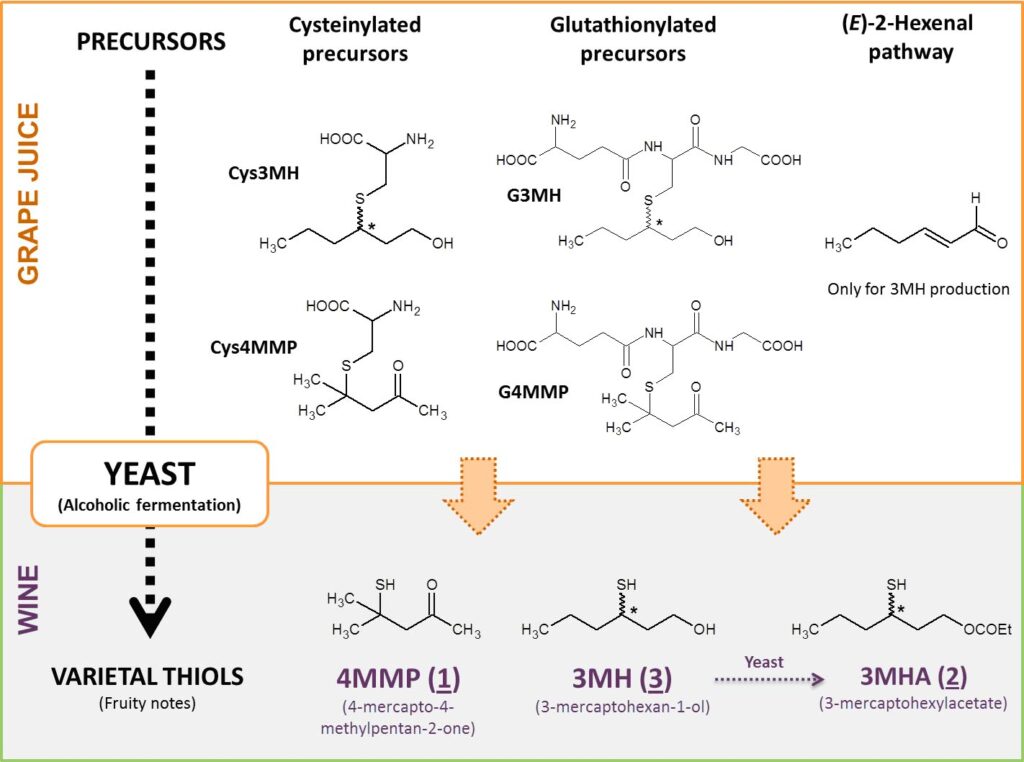
Tres rutas biogenéticas de formación de la 4MMP y del 3MH han sido identificadas en los vinos (fig. 2). La formación del 3MHA es especial y se hace por acetilación del 3MH por la levadura.28
s
La primera vía implicando precursores cisteinilados fue identificada por primera vez en la uva sauvignon blanc,29,30 merlot y cabernet sauvignon,16 semillon,31 petit y gros manseng,12 riesling, melon b. y gewürztraminer32 y, finalmente, koshu.33 Estos conjugados de la S-cisteína son escindidos por la levadura con la actividad β-liasa durante los primeros días de fermentación.30 La S-3-(hexan-1-ol)-cisteína (Cys3MH) es mas ubicua y abundante que la S-3-(4-mercapto-4-metil-2-ona)-cisteína (Cys4MMP),16,34,35 lo que es consistente con las proporciones relativas de los tioles correspondientes. Estos precursores cisteinilados se encuentran frecuentemente en las plantas como recuerda Starkenmann36 y, por lo tanto, constituyen una fuente importante de aroma para la industria.
La segunda vía implica precursores glutathionilados: el S-3-(hexano-1-ol)-glutatión (G3MH) identificado de manera tentativa en la uva de sauvignon blanc,37 y formalmente en la de melon b.,34 riesling32 y gewürztraminer,32 y luego Chardonnay,38 pinot gris38 y koshu33 y el s-3-(4-mercapto-4-metil-2-ona)-glutatión (G4MMP) presente en la uva de sauvignon blanc,39 riesling y gewürztraminer.34 Diferentes estudios realizados en medio modelo40,33 o en mostos de sauvignon blanc32, dopado con G3MH y después fermentado mostraron la presencia en los vinos correspondientes de 3MH. Se demostró así que el G3MH era otro precursor del 3MH. Se observaron resultados similares para el G4MMP en mostos de sauvignon Blanc.41
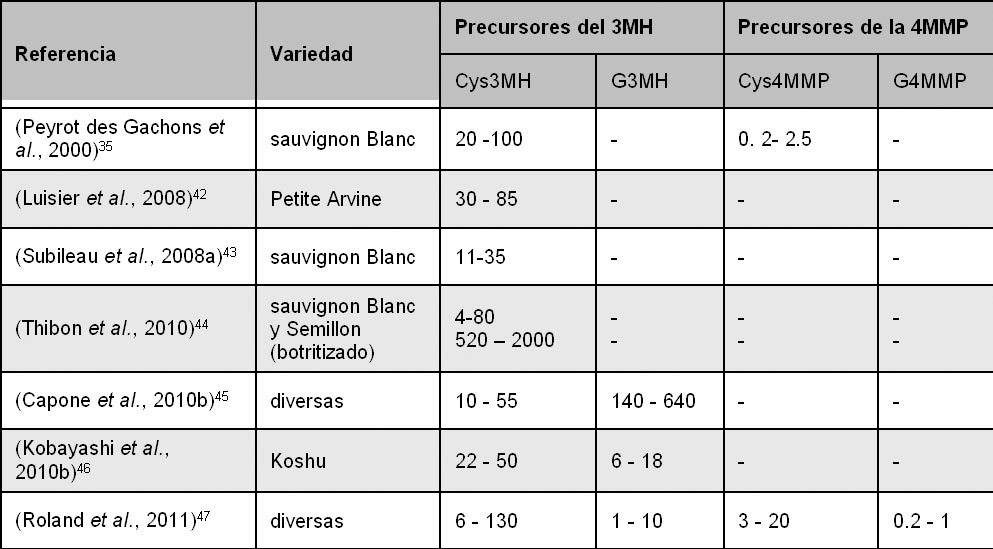
La formas glutationiladas están generalmente presentes en las uvas y mostos a niveles inferiores a las formas cisteiniladas,41 y el G3MH es siempre mucho más concentrado que el G4MMP lo que es coherente con la distribución de los tioles correspondientes en los vinos (tabla 1). Las concentraciones varían entre 0,2 y 7,3 µg/l para el sauvignon blanc, el melon b., el riesling y el gewürztraminer;41 Los contenidos en G4MMP son mucho más bajos, entre 0,03 y 4,3 µg/L.
s
Por último, una última vía de biogénesis ha sido identificada en el pasado. Esta ruta implica compuestos insaturados en C6 tal como el (E)-2-hexenal que reciben un grupo sulfhídrico durante la fermentación alcohólica.48 Sin embargo, el donador de azufre aún no ha sido identificado: podrían ser compuestos tales como el H2S, la cisteína, el glutatión u otros compuestos que poseen un tiol libre en los mostos.
v
Los principales factores de variación en la viña
Los cambios en los precursores de tioles en el viñedo han sido poco estudiados, debido a la dificultad de análisis. Los pocos resultados disponibles conciernen a los efectos de la madurez, la ubicación del viñedo (terroir), el nivel de estrés hídrico y la fertilización nitrogenada. La evolución de los precursores cisteinilados durante la maduración se ha estudiado desde el principio de la década del 2000 en sauvignon: si la maduración es favorable a la acumulación de estos precursores en los granos, la cosecha es muy importante.35 Se demostraron similares resultados en Sancerre y Touraine con la uva sauvignon y para todos los conjugados de la cisteína y del glutatión aunque la evolución de la Cys4MMP parezca más dependiente de la ubicación física de la vid.49
El nivel de estrés hídrico tiene un efecto sobre los precursores cisteinilados y en este contexto, los contenidos en Cys3MH parecen proporcionales al nivel de estrés (en la región de Burdeos), mientras que la Cys4MMP tiene un comportamiento opuesto.50
El mismo autor informa de una relación entre la fertilización de nitrógeno en el suelo y el contenido en precursores (y glutatión) mientras que disminuye el nivel de polifenoles que contribuye a la producción de vinos más ricos en tioles.51 Del mismo modo, la pulverización foliar de nitrógeno después el envero aumenta el contenido en tioles de los vinos sin aumentar el vigor y ni el Botrytis cinerea como puede ocurrir en el caso de una fertilización de nitrógeno en el suelo mal controlado.52 Este aumento en tioles, parece más debido al efecto del aumento en nitrógeno asimilable de los mostos que en el aumento directo de los precursores.
v
Los principales factores de variación durante la vinificación
Durante la preparación de los mostos
La elaboración de los mostos es un paso clave en el proceso de vinificación de los vinos blancos y rosados.
El prensado de la uva provoca una liberación en el medio de ácidos hidroxicinámicos (ácido caftarico principalmente), que, en presencia de polifenoloxidasa endógena y de oxígeno produce o-quinonas. Cuando está presente el glutatión en el vino, estas quinonas reaccionan con este tripéptido para formar el GRP (grape reaction product).53,54 Cuando el contenido en glutatión baja, estas quinonas se condensan con otros sustratos polifenólicos tales como los flavonoides para formar pigmentos marrones.
Durante este etapa de elaboración del vino, los tioles varietales están presentes en forma de S-conjugados y no son oxidables, dado la estabilidad en condiciones enológicas del enlace tioéter. Consistentemente, Roland et al.49 han mostrado que los niveles de precursores cisteinilados al 3MH y a la 4MMP y que la G4MMP eran estables durante los experimentos de oxidación controlada sobre mostos de sauvignon y de Melon mientras que las concentraciones en G3MH aumentaban. Esta formación puede ser el resultado de la adición de glutatión sobre el (E)-2-hexenal, un producto de la oxidación enzimática de los lípidos insaturados de la uva. Asi esta reacción podría explicar la formación de G3MH durante las operaciones prefermentativas.49
Otras técnicas tal como la maceración permiten aumentar el contenido en tioles de los vinos. La localización de los precursores de tioles en el grano de uva, de preferencia en la piel, explica la ganancia en precursores después de la maceración lo que ya ha sido observado por varios autores.55,16,56,57 Hay que señalar que en esta asignación, existen diferencias entre los precursores (Cys4MMP más en la pulpa que en la piel) o entre las variedades (el G3MH de la variedad Melon está preferentemente en la pulpa). Además, al producirse la extracción conjunta de los polifenoles durante la maceración los enólogos deben ser moderados con esta técnica, ya que son perjudiciales para el mantenimiento de los tioles en los vinos (ver más adelante apartado sobre el envejecimiento).
Durante la fermentación alcohólica
Los tioles varietales son liberados durante los primeros días de fermentación por Saccharomyces cerevisiae a través de su actividad de β-liasa. Según los autores, varios58 o un solo gen, IRC759 están implicados en la escisión de la Cys4MMP. La conversión del Cys3MH parece más compleja. En estos estudios, el determinismo genético de la reacción de escisión sólo concierne a los conjugados de S-cisteína y no existen datos disponibles para los conjugados del glutatión. Por lo tanto, la elección de la cepa de levadura es un factor crítico en la producción tioles en los vinos. Muchas levaduras comerciales tienen una buena capacidad para liberar tioles.58,60-62 Sin embargo, seria arriesgado intentar clasificar las cepas por orden de eficacia ya que un estudio reciente ha demostrado que el origen del vino y su composición, eran factores importantes de diferenciación de los vinos (Schneider, comunicación personal). Por otra parte, hay que señalar que la combinación de cepas puede ser una manera eficaz para aumentar la producción de 3MH y 3MHA.63 Estudios recientes han puesto de relieve el interés de las cepas no-Saccharomyces como Pichia kluyveri64 o híbridos interespecíficos tal como S. cerevisiae x S. bayanus var. uvarum.62,65 Sin embargo, hay que tener en cuenta que los rendimientos de conversión de levadura no es superior al 10% en enología.
Sin embargo, pocos estudios se han centrado en el tema del transporte de los precursores de tioles en la célula de la levadura, una etapa clave para la escisión. El transportador de aminoácidos ha sido identificado como un transportador de precursores cisteinilados en medios modelos.66 La síntesis de este transportador se reprime por un exceso de amonio (Nitrogen Catabolic Repression). Así, el tipo y el momento de adición de nutrientes nitrogenados durante la fermentación debe ser controlado para permitir una mejora en la producción de tioles en vinos.
La temperatura de fermentación es también un factor importante que afecta la producción de tioles. La fermentación a 20 °C parece ser más favorable que a 13°C,67 pero esta observación parece depender de la cepa de levadura considerada.58
Durante el almacenamiento y el envejecimiento
Después de la fermentación, los tioles están en forma libre, y por lo tanto son químicamente inestables y fácilmente oxidables. Reaccionan fácilmente con otros compuestos de vino por adición nucleófila.68,69
Se debe controlar cuidadosamente las aportaciones de oxígeno a partir de este momento. Por ejemplo, hay que cuidar el oxígeno en el espacio de cabeza al embotellado y el OTR (Oxygen Transmission Rate) de los corchos ya que pueden provocar pérdidas aromaticas significativas a partir de un período de almacenamiento de 24 meses.70,12,71 Dependiendo del tipo de vino, el oxígeno puede ser perjudicial para la calidad aromática porque además de provocar colores marrones puede disminuir el contenido en tioles varietales72. Los mecanismos subyacentes implican la formación de aductos entre las moléculas de tiol, que son electrófilas, y algunos compuestos fenólicos.73 Así, la presencia de (+)-catequina y (-)-epicatequina con hierro (III) cataliza su oxidación en quinonas que se añaden a los tioles.
Sin embargo, la ausencia de oxígeno en el embotellado puede causa la aparición de defectos de reducción significativa y se debe encontrado un promedio de acuerdo con el tipo de vino y su duración de «vida».
El envejecimiento sobre lías antes del embotellado, la presencia constante de SO2 libre, de glutatión y de antocianinas en el caso de los vinos tintos y rosados, favorecen una mejora preservación de los aromas del vino.74,75,76
v
Conclusión
Los aromas del vino de tipo tiol son fuertemente influenciadas por las técnicas vitícolas y enológicas. Cuando uno quiere producir un vino con un alto contenido en tiol, es necesario:
– Favorecer la acumulación de los precursores en la uva.
– Manejar la extracción de los precursores en los mostos blancos y rosados.
– Aumentar los ratios de conversión eligiendo una cepa de levadura, condiciones de fermentación y una nutrición nitrogenada adecuadas.
– Y, finalmente, mantener los compuestos producidos en los vinos mediante controles de oxigeno por ejemplo.
Hay que llevar a cabo numerosos estudios en estas áreas para poder manejar la vinification del vino, pero los resultados presentados aquí sugieren algunas pistas que se pueden integrar en los procesos de elaboración.
Además, si la contribución de los tioles es bien conocida en ciertos modelos de vinos (cabernet, colombard, algunos vinos rosados) los trabajos futuros deberían permitir entender mejor el papel de las interacciones de estos compuestos con otros compuestos volátiles lo que implica una fuerte colaboración multidisciplinar de la química con la fisiología del olfato.
v
Nota:
Este artículo está basado en la intervención de uno de los autores (Rémi Schneider) en la Jornada titulada Proyecto Vinaromas: coloquio internacional sobre los aromas del vino, que tuvo lugar en Zaragoza el 22 de noviembre de 2012. Para más información sobre el proyecto visite www.projet-vinaromas.eu.
v
Bibliografía
1. Du Plessis CS, Augustyn OPH. «Initial study on the guava aroma of Chenin Blanc and Colombar wines». S Afr J Enol Vitic 1981; 2 (2): 101-3.
2. Darriet P, Lavigne V, Boidron JN, Dubourdieu D. «Caractérisation de l’arôme variétal des vins de Sauvignon par couplage CPG-Olfactométrie». J Int Sci Vigne Vin 1999; 25 (3): 167-74.
3. Darriet P, Tominaga T, Lavigne V, Boidron JN, Dubourdieu D. «Mise en évidence dans le raisin de Vitis vinifera J. (var. Sauvignon) d’un précurseur de la 4-méthyl-4-mercaptopentan-2-one». C R Acad Sci Paris 1993; 316: 1332-5.
4. Darriet P, Tominaga T, Lavigne V, Boidron JN, Dubourdieu D. «Identification of a powerful aromatic component of Vitis vinifera L.var. Sauvignon wines: 4-mercapto-4-methylpentan-2-one». Flavour Fragrance J 1995; 10: 385-92.
5. Guth H. Quantitation and Sensory Studies of Character Impact Odorants of Different White Wine Varieties. J Agric Food Chem 1997; 45 (8): 3027-32.
6. Escudero A, Gogorza B, Melus MA, Ortin N, Cacho J, Ferreira V. Characterization of the aroma of a wine from maccabeo. Key role played by compounds with low odor activity values. J Agric Food Chem 2004; 52 (11): 3516-24.
7. Dubourdieu D, Tominaga T. «Polyfunctionnal Thiol Compounds». En: Moreno-Arribas, V., Polo, C., eds. Wine chemistry and biochemistry. NY/Berlin: Springer, 2009, p. 275.
8. Tominaga T, Baltenweck-Guyot R, Gachons CPD, Dubourdieu D. Contribution of Volatile Thiols to the Aromas of White Wines Made From Several Vitis vinifera Grape Varieties. Am J Enol Vitic 2000; 51 (2): 178-81.
9. Tominaga T, Darriet P, Dubourdieu D. Identification of 3-mercaptohexanol acetate, compound having a powerful odor reminiscent of box-tree, involved in the aroma of Sauvignon wines. Vitis 1996; 35: 207-10.
10. Tominaga T, Furrer A, Henry R, Dubourdieu D. Identification of new volatile thiols in the aroma of Vitis vinifera L. var. Sauvignon blanc wines. Flavour Fragrance J 1998; 13 (3): 159-62.
11. Fretz CB, Luisier J-L, Tominaga T, Amado R. 3-Mercaptohexanol: An Aroma Impact Compound of Petite Arvine Wine. Am J Enol Vitic 2005; 56 (4): 407-10.
12. Lopes P, Saucier C, Glories Y. Nondestructive Colorimetric Method To Determine the Oxygen Diffusion Rate through Closures Used in Winemaking. J Agric Food Chem 2005; 53 (18): 6967-73.
13. Schneider R, Kotseridis Y, Ray JL, Augier C, Baumes R. Quantitative determination of sulfur-containing wine odorants at sub parts per billion levels. 2. Development and application of a stable isotope dilution assay. J Agric Food Chem 2003; 51 (11): 3243-8.
14. Campo E, Ferreira V, Escudero A, Cacho J. Prediction of the Wine Sensory Properties Related to Grape Variety from Dynamic-Headspace Gas Chromatography-Olfactometry Data. J Agric Food Chem 2005; 53 (14): 5682-90.
15. Ferreira V, Ortin N, Escudero A, Lopez R, Cacho J. Chemical characterization of the aroma of Grenache rose wines: aroma extract dilution analysis, quantitative determination, and sensory reconstitution studies. J Agric Food Chem 2002; 50 (14): 4048-54.
16. Murat M-L, Tominaga T, Dubourdieu D. Assessing the Aromatic Potential of Cabernet Sauvignon and Merlot Musts Used to Produce Rose Wine by Assaying the Cysteinylated Precursor of 3-Mercaptohexan-1-ol. J Agric Food Chem 2001; 49: 5412-7.
17. Bouchilloux P, Darriet P, Henry R, Lavigne-Cruege V, Dubourdieu D. Identification of Volatile and Powerful Odorous Thiols in Bordeaux Red Wine Varieties. J Agric Food Chem 1998; 46 (8): 3095-9.
18. Masson G, Schneider R. Key Compounds of Provence Rose Wine Flavor. Am J Enol Vitic 2009; 60 (1): 116-22.
19. Murat ML, Tominaga T, Dubourdieu D. Impact of some components on Bordeaux rosé and clairets. J Int Sci Vigne Vin 2001; 35: 99-105.
20. Blanchard L. Recherche sur la contribution de certains thiols volatils à l’arôme des vins rouges. Etude de leur genèse et de leur stabilité. Burdeos: Université Victor Segalen, 2000.
21. Guth H. Identification of Character Impact Odorants of Different White Wine Varieties. J Agric Food Chem 1997; 45 (8): 3022-6.
22. Sarrazin E, Dubourdieu D, Darriet P. Characterization of key-aroma compounds of botrytized wines, influence of grape botrytization. Food Chem 2007; 103 (2): 53645.
23. Culleré L, Escudero A, Cacho J, Ferreira V. Gas chromatography-olfactometry and chemical quantitative study of the aroma of six premium quality spanish aged red wines. J Agric Food Chem 2004; 52 (6): 1653-60.
24. Lopez R, Ortin N, Perez-Trujillo JP, Cacho J, Ferreira V. Impact Odorants of Different Young White Wines from the Canary Islands. J Agric Food Chem 2003; 51 (11): 3419-25.
25. Lund CM, Thompson MK, Benkwitz F, Wohler MW, Triggs CM, Gardner R, Heymann H, Nicolau L. New Zealand Sauvignon blanc Distinct Flavor Characteristics: Sensory, Chemical, and Consumer Aspects. Am J Enol Vitic 2009; 60 (1): 1-12.
26. King ES, Osidacz P, Curtin C, Bastian SEP, Francis IL. Assessing desirable levels of sensory properties in Sauvignon Blanc wines – consumer preferences and contribution of key aroma compounds. Austr J Grape Wine R 2011; 17 (2): 169-80.
27. Green JA, Parr WV, Breitmeyer J, Valentin D, Sherlock R. Sensory and chemical characterisation of Sauvignon blanc wine: Influence of source of origin. Food Res Int 2011; 44 (9): 2788-97.
28. Swiegers JH, Pretorius IS. Modulation of volatile sulfur compounds by wine yeast. Appl Microbiol Biotechnol 2007; 74: 954-60.
29. Tominaga T, Masneuf I, Dubourdieu D. Mise en évidence d’un S-conjugué de la cystéine, précurseurs d’arôme du Sauvignon. J Int Sci Vigne Vin 1995; 29: 227-232.
30. Tominaga T, Peyrot des Gachons C, Dubourdieu D. A New Type of Flavor Precursors in Vitis vinifera L. cv. Sauvignon Blanc: S-Cysteine Conjugates. J Agric Food Chem 1998; 46: 5215-9..
31. Thibon C, Dubourdieu D, Darriet P, Tominaga T. Impact of noble rot on the aroma precursor of 3-sulfanylhexanol content in Vitis vinifera L. cv Sauvignon blanc and Semillon grape juice. Food Chem 2009; 114 (4): 1359-64.
32. Roland A, Schneider R, Le Guernevé C, Razungles A, Cavelier F. Identification and quantification by LC-MS/MS of a new precursor of 3-mercaptohexan-1-ol (3MH) using stable isotope dilution assay: Elements for understanding the 3MH production in wine. Food Chem 2010; 121: 847-55.
33. Kobayashi H, Takase H, Kaneko K, Tanzawa F, Takata R, Suzuki S, Konno T. Analysis of S-3- (hexan-1-ol)-glutathione and S-3- (hexan-1-ol)-L-cysteine in Vitis vinifera L. cv. Koshu for aromatic wines. Am J Enol Vitic 2010; 61 (2): 176-85.
34. Roland A, Vialaret J, Moniatte M, Rigou P, Razungles A, Schneider R. Validation of a nano liquid chromatography-tandem mass spectrometry method for the identification and the accurate quantification by isotopic dilution of glutathionylated and cysteinylated precursors of 3-mercaptohexan-1-ol and 4-mercapto-4-methylpentan-2-one in white grape juices. J Chromatogr A 2010; 1217: 1626-35.
35. Peyrot des Gachons C, Tominaga T, Dubourdieu D. Measuring the Aromatic Potential of Vitis vinifera L. Cv. Sauvignon Blanc Grapes by Assaying S-Cysteine Conjugates, Precursors of the Volatile Thiols Responsible for Their Varietal Aroma. J Agric Food Chem 2000; 48: 3387-91.
36. Starkenmann C, Troccaz M, Howell K. The role of cysteine and cysteine-S conjugates as odour precursors in the flavour and fragrance industry. Flavour Fragrance J 2008; 23 (6): 369-81.
37. Peyrot des Gachons C, Tominaga T, Dubourdieu D. Sulfur Aroma Precursor Present in S-glutathione Conjugate Form: Identification of S-3- (Hexan-1-ol)-glutathione in Must from Vitis vinifera L. cv. Sauvignon Blanc. J Agric Food Chem 2002; 50: 4076-9.
38. Capone DL, Sefton MA, Hayasaka Y, Jeffery DW. Analysis of Precursors to Wine Odorant 3-Mercaptohexan-1-ol Using HPLC-MS/MS: Resolution and Quantitation of Diastereomers of 3-S-Cysteinylhexan-1-ol and 3-S-Glutathionylhexan-1-ol. J Agric Food Chem 2010; 58 (3): 1390-5.
39. Fedrizzi B, Pardon KH, Sefton MA, Elsey GM, Jeffery DW. First Identification of 4-S-Glutathionyl-4-methylpentan-2-one, a Potential Precursor of 4-Mercapto-4-methylpentan-2-one, in Sauvignon Blanc Juice. J Agric Food Chem 2009; 57 (3): 991-5.
40. Grant-Preece PA, Pardon KH, Capone DL, Cordente AG, Sefton MA, Jeffery DW, Elsey GM. Synthesis of Wine Thiol Conjugates and Labeled Analogues: Fermentation of the Glutathione Conjugate of 3-Mercaptohexan-1-ol Yields the Corresponding Cysteine Conjugate and Free Thiol. J Agric Food Chem 2010; 58 (3): 1383-9.
41. Roland A, Schneider R, Razungles A, Le Guernevé C, Cavelier F. Straightforward synthesis of deuterated precursor to demonstrate the biogenesis of aromatic thiols in wine. J Agric Food Chem 2010; 58: 10684-9.
42. Luisier J-L, Buettner H, lker S, Rausis T, Frey U. Quantification of Cysteine S-Conjugate of 3-Sulfanylhexan-1-ol in Must and Wine of Petite Arvine Vine by Stable Isotope Dilution Analysis. J Agric Food Chem 2008; 56 (9): 2883-7.
43. Subileau M, Schneider R, Salmon J-M, Degryse E. New Insights on 3-Mercaptohexanol (3MH) Biogenesis in Sauvignon Blanc Wines: Cys-3MH and (E)-Hexen-2-al Are Not the Major Precursors. J Agric Food Chem 2008; 56 (19): 9230-5.
44. Thibon C, Shinkaruk S, Jourdes M, Bennetau B, Dubourdieu D, Tominaga T. Aromatic potential of botrytized white wine grapes: Identification and quantification of new cysteine-S-conjugate flavor precursors. Anal Chim Acta 2010; 660 (1-2): 190-6.
45. Capone DL, Sefton MA, Hayasaka Y, Jeffery DW. 2010b. Analysis of Precursors to Wine Odorant 3-Mercaptohexan-1-ol Using HPLC-MS/MS: Resolution and Quantitation of Diastereomers of 3-S-Cysteinylhexan-1-ol and 3-S-Glutathionylhexan-1-ol. J Agric Food Chem 2010; 58 (3): 1390-5.
46. Kobayashi H, Takase H, Kaneko K, Tanzawa F, Takata R, Suzuki S, Konno T. Analysis of S-3- (hexan-1-ol)-glutathione and S-3- (hexan-1-ol)-L-cysteine in Vitis vinifera L. cv. Koshu for aromatic wines. Am J Enol Vitic 2010; 61 (62): 176-85.
47. Roland A, Schneider R, Razungles A, Cavelier F. Varietal Thiols in Wine: Discovery, Analysis and Applications. Chemical Reviews 2001; 111 (11): 7355-76.
48. Schneider R, Charrier F, Razungles A, Baumes R. Evidence for an alternative biogenetic pathway leading to 3-mercaptohexanol and 4-mercapto-4-methylpentan-2-one in wines. Anal Chim Acta 2006; 563 (1-2): 58-64.
49. Roland A, Vialaret J, Razungles A, Rigou P, Schneider R. Evolution of S-cysteinylated and S-glutathionylated thiol precursors during oxidation of Melon B. and Sauvignon blanc musts. J Agric Food Chem 2010; 58 (7): 4406-13.
50. Choné X. Contribution à l’étude des terroirs de Bordeaux : étude des déficits hydriques modérés, de l’alimentation en azote et de leurs effets sur le potentiel aromatique des raisins de Vitis vinifera L. cv. Sauvignon blanc. Burdeos: Université de Bordeaux, 2001, p. 188.
51. Choné X, Lavigne-Cruège V, Tominaga T, Leeuwen CV, Castagnède C, Saucier C, Dubourdieu D. Effect of vine nitrogen status on grape aromatic potential: Flavor precursors (S-cysteine conjugates), glutathione and phenolic content in Vitis vinifera L. cv. Sauvignon Blanc grape juice. J Int Sci Vigne Vin 2006; 40 (1): 1-6.
52. Lacroux F, Tregoat O, Leeuwen CV, Pons A, Tominaga T, Lavigne-Cruège V, Dubourdieu D. Effect of foliar nitrogen and sulphur application on aromatic expression of Vitis vinifera L. cv. Sauvignon Blanc. J Int Sci Vigne Vin 2008; 42 (3): 125-32.
53. Cheynier VF, Trousdale EK, Singleton VL, Salgues MJ, Wylde R. Characterization of 2-S-glutathionyl caftaric acid and its hydrolysis in relation to grape wines. J Agric Food Chem 1986; 34 (2): 217-21.
54. Singleton VL, Salgues M, Zaya J, Trousdale E. Caftaric Acid Disappearance and Conversion to Products of Enzymic Oxidation in Grape Must and Wine. Am J Enol Vitic 1985; 36 (1): 50-56.
55. Peyrot des Gachons C, Tominaga T, Dubourdieu D. Localisation of S-cysteine conjugates in the berry: Effect of skin contact on aromatic potential of Vitis vinifera L. cv. Sauvignon Blanc must. Am J Enol Vitic 2002; 53 (2): 144-6.
56. Maggu M, Winz R, Kilmartin PA, Trought MCT, Nicolau L. Effect of Skin Contact and Pressure on the Composition of Sauvignon Blanc Must. J Agric Food Chem 2007; 55 (25): 10281-8.
57. Roland A, Schneider R, Charrier F, Cavelier F, Rossignol M, Razungles A. Distribution of varietal thiol precursors in skin and pulp for Melon B. and Sauvignon Blanc grapes. Food Chem 2010; 125: 139-44.
58. Howell KS, Swiegers JH, Elsey GM, Siebert TE, Bartowsky EJ, Fleet GH, Pretorius IS, de Barros Lopes MA. Variation in 4-mercapto-4-methyl-pentan-2-one release by Saccharomyces cerevisiae commercial wine strains. FEMS Microbiol Lett 2004; 240 (2): 125-9.
59. Thibon C, Marullo P, Claisse O, Cullin C, Dubourdieu D, Tominaga T. Nitrogen catabolic repression controls the release of volatile thiols by Saccharomyces cerevisiae during wine fermentation. FEMS Yeast Res 2008; 8 (7): 1076-86.
60. Murat M-L, Masneuf I, Darriet P, Lavigne V, Tominaga T, Dubourdieu D. Effect of Saccharomyces cerevisiae Yeast Strains on the Liberation of Volatile Thiols in Sauvignon blanc Wine. Am J Enol Vitic 2001a; 52 (2): 136-9.
61. Swiegers JH, Francis IL, Herderich MJ, Pretorius IS. Meeting consumer expectations through management in vineyard and winery: the choice of yeast for fermentation offers great potential to adjust the aroma of Sauvignon Blanc wine. Austral NZ Wine Ind 2006; 21: 34-42.
62. Dubourdieu D, Tominaga T, Masneuf I, Peyrot des Gachons C, Murat ML. The Role of Yeasts in Grape Flavor Development during Fermentation: The Example of Sauvignon blanc. Am J Enol Vitic 2006; 57 (1): 81-8.
63. King ES, Swiegers JH, Travis B, Francis IL, Bastian SE, Pretorius IS. Coinoculated fermentations using saccharomyces yeasts affect the volatile composition and sensory properties of Vitis vinifera L. cv. sauvignon blanc wines. J Agric Food Chem 2008; 56 (22): 10829-37
64. Anfang N, Brajkovich M, Goddard MR. Co-fermentation with Pichia kluyveri increases varietal thiol concentrations in Sauvignon Blanc. Aust J Grape Wine R 2009; 15 (1): 1-8.
65. Masneuf I, Murat ML, Naumov GI, Tominaga T, Dubourdieu D. Hybrids Saccharomyces cerevisiae x Saccharomyces bayanus var-uavrum having a high liberating ability of some sulfur varietal aromas of Vitis vinifera Sauvignon blanc wines. J Int Sci Vigne Vin 2002; 36: 205-212.
66. Subileau M, Schneider R, Salmon J-M, Degryse E. Nitrogen catabolite repression modulates the production of aromatic thiols characteristicof Sauvignon Blanc at the level of precursor transport. FEMS Yeast Res 2008b; 8: 771-780.
67. Masneuf-Pomarede I, Mansour C, Murat ML, Tominaga T, Dubourdieu D. Influence of fermentation temperature on volatile thiols concentrations in Sauvignon blanc wines. Int J Food Microbiol 2006; 108 (3): 385-90.
68. Hofmann T, Schieberle P, Grosch W. Model Studies on the Oxidative Stability of Odor-Active Thiols Occurring in Food Flavors.J Agric Food Chem 1996; 44 (1): 251-5.
69. Sarrazin E, Sinkharuk S, Pons M, Thibon C, Bennetau B, Darriet P. Elucidation of the 1,3-Sulfanylalcohol Oxidation Mechanism: An Unusual Identification of the Disulfide of 3-Sulfanylhexanol in Sauternes Botrytized Wines. J Agric Food Chem 2010; 58 (19): 10606-13.
70. Lopes P, Silva MA, Pons A, Tominaga T, Lavigne V, Saucier C, Darriet P, Teissedre P-L, Dubourdieu D. Impact of Oxygen Dissolved at Bottling and Transmitted through Closures on the Composition and Sensory Properties of a Sauvignon Blanc Wine during Bottle Storage. J Agric Food Chem 2009; 57 (21): 10261-70.
71. Lopes P, Saucier Cd, Teissedre P-L, Glories Y. Impact of Storage Position on Oxygen Ingress through Different Closures into Wine Bottles. J Agric Food Chem 2006; 54 (18): 6741-6.
72. Skouroumounis GK, Kwiatkowski MJ, Francis IL, Oakey H, Capone DL, Duncan B, Sefton MA, Waters EJ. The impact of closure type and storage conditions on the composition, colour and flavour properties of a Riesling and a wooded Chardonnay wine during five years’ storage. Aust J Grape Wine R 2005; 11 (3): 369-377.
73. Nikolantonaki M, Chichuc I, Teissedre P-L, Darriet P. Reactivity of volatile thiols with polyphenols in a wine-model medium: Impact of oxygen, iron, and sulfur dioxide. Anal Chim Acta 2009; 660 (1-2): 102-9.
74. Blanchard L, Darriet P, Dubourdieu D. Reactivity of 3-Mercaptohexanol in Red Wine: Impact of Oxygen, Phenolic Fractions, and Sulfur Dioxide. Am J Enol Vitic 2004; 55 (2): 115-20.
75. Brajkovich M, Tibbits N, Peron G, Lund CM, Dykes SI, Kilmartin PA, Nicolau L. Effect of screwcap and cork closures on SO2 levels and aromas in a Sauvignon Blanc wine. J Agric Food Chem 2005; 53 (26): 10006-11.
76. Murat M-L, Tominaga T, Saucier C, Glories Y, Dubourdieu D. Effect of Anthocyanins on Stability of a Key Odorous Compound, 3-Mercaptohexan-1-ol, in Bordeaux Rose Wines. Am J Enol Vitic 2003; 54 (2): 135-8.