La transformación de mosto de uva en vino es un proceso ecológico y bioquímico complejo que implica el desarrollo secuencial de especies microbianas tales como levaduras, bacterias lácticas y bacterias acéticas.1 En las primeras etapas de la fermentación del vino, varias docenas de especies de levadura puede estar presentes, pero, a medida que aumenta la concentración de alcohol, la población de levaduras progresivamente se ve dominada por levaduras pertenecientes al género Saccharomyces.2 A pesar de este dominio de las cepas de S. cerevisiae, el desarrollo controlado de las especies no Saccharomyces puede contribuir a las propiedades de aroma y composición química del vino por la síntesis de metabolitos de interés organoléptico.3 Además de la contribución aromática de estas especies minoritarias, algunos autores han informado de la liberación de enzimas de diversos tipos,4 enzimas extracelulares que pueden ser responsables de proporcionar al vino con propiedades únicas de la región de su producción, la liberación de compuestos derivados de la pared celular;5 o la reducción del grado alcohólico final del vino,6 una aplicación muy prometedora para hacer frente a los problemas derivados del actual contexto de cambio climático.
Sin embargo, si el crecimiento controlado de estas especies no Saccharomyces puede contribuir positivamente a la calidad del vino, un crecimiento excesivo, incontrolado o por parte de determinadas cepas de estas especies, puede suponer claramente una alteración del vino y la producción de aromas desagradables como excesiva producción de acidez volátil.
contribuir positivamente a la calidad del vino, un crecimiento excesivo, incontrolado o por parte de determinadas cepas de estas especies, puede suponer claramente una alteración del vino y la producción de aromas desagradables como excesiva producción de acidez volátil.
Por todo ello, hoy en día, existe la idea mayoritaria de que, al igual que se hizo ya hace unas décadas para S. cerevisiae, hay que realizar selección de las mejores cepas de estas especies e incorporar a las mismas a la cadena de producción, para que el enólogo disponga de las mismas en formato similares al de cepas de S. cerevisiae. Esto aunaría las ventajas de una fermentación controlada desde el punto de vista microbiológico, con una diversidad metabólica que permita recuperar los rasgos más interesantes de una fermentación espontánea.3
La industria del vino actualmente propone utilizar, estando ya disponible algunas de ellas en el mercado, levaduras no convencionales como Torulaspora delbrueckii, Metschnikowia pulcherrima, Pichia kluyveri, Lachancea thermotolerans, etc., mientras que varias otras especies como Hanseniaspora uvarum, Starmerella bacillaris, etc., son objeto de diversos estudios para evaluar tanto la contribución positiva como el impacto negativo que podrían tener sobre la calidad del vino.7
En el caso de bacterias lácticas y acéticas, su contribución a la fermentación alcohólica es nula y su desarrollo siempre está ligado a alteraciones, como comentaremos posteriormente. A continuación, me centraré en la evolución de estas poblaciones microbianas durante una fermentación alcohólica controlada para posteriormente destacar las posibles desviaciones de esta dinámica poblacional que acarrean alteraciones perjudiciales para la calidad final del vino.
Evolución de las poblaciones microbianas en el vino
La fermentación del mosto de uva puede ser considerada como un proceso microbiano heterogéneo. El número de levaduras en la uva, justo antes de la cosecha varía de 103 a 106 células/mL8 en función de las variedades de uvas, las condiciones climáticas, prácticas vitícolas, etapa de maduración, el daño físico (causada por hongos, insectos y aves) y fungicidas aplicados a los viñedos.9 Aunque, el mosto de uva es relativamente completo en cuanto a nutrientes, el bajo pH y el alto contenido en azúcar determinan que solo unas pocas bacterias y especies de levaduras pueden crecer. Además, la adición de dióxido de azufre, principal compuesto antioxidante y antimicrobiano, impone una selección adicional, principalmente contra bacterias y levaduras con menor poder fermentativo.
Otro factor importante es la restricción creada por las condiciones anaeróbicas una vez iniciada la fermentación. Al inicio de la fermentación, las especies de levaduras predominantes pertenecen a los géneros Hanseniaspora, Candida, Pichia, Metschnikowia, Kluyveromyces, Zygosaccharomyces, Torulaspora, Starmerella, Dekkeray Schizosaccharomyces. Por el contrario, la población de la principal levadura vínica S. cerevisiae en el mosto es muy baja (fig. 1).10
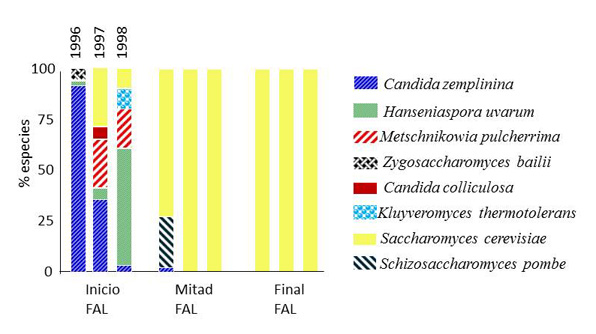
[Fuente: Esta figura ha sido adaptada del trabajo publicado por Torija et al., 2001]10
Las levaduras no Saccharomyces proliferan en los primeros días de fermentación hasta poblaciones aproximadamente de 106 – 107 células/mL. Sin embargo, la fermentación alcohólica es un ecosistema que fluctúa con gran rapidez, y en pocos días, el aumento de la concentración de etanol, el agotamiento de nutrientes claves como el nitrógeno y el aumento constante de la temperatura de fermentación favorecen la rápida proliferación de las cepas de S. cerevisae en detrimento de estas otras especies mayoritarias en el mosto de uva.11,12 Así, con el establecimiento de la fermentación tumultuosa, el predominio de S. cerevisiae es prácticamente absoluto, llegando a alcanzar poblaciones entre 5,107 – 108 ufc/mL. En ocasiones, algunas especies de Brettanomyces, Kluyveromyces, Schizosaccharomyces, Torulaspora y Zygosaccharomyces aparecen en fases finales de la fermentación alcohólica. Sin embargo, esta presencia suele ir asociada a fermentaciones problemáticas y que acaban en alteraciones de la calidad del vino final, como comentaré más adelante.
Diferentes especies de bacterias lácticas han sido descritas durante la fermentación alcohólica. De manera similar a lo que ocurre con las levaduras, la principal especie vínica Oenococcus oeni es difícil de aislar en el mosto de uva, siendo mayoritarias especies de Lactobacillus como L. plantarum, L. casei, L. hilgardii y L. brevis; y especies de Pediococcus como P. damnosus y P. pentosaceus.
En cuanto al tamaño poblacional de las bacterias lácticas, en el mosto podemos hacer recuentos que van de 102 a 104 ufc/mL. La evolución de estas poblaciones durante la fermentación alcohólica depende fundamentalmente del pH del mosto y del SO2 añadido al mismo. Por lo general, pH inferiores a 3,6 y la adición del antimicrobiano en las concentraciones habituales inhiben completamente el crecimiento de las bacterias lácticas durante la fermentación alcohólica. Sin embargo, a pesar de que no haya proliferación sí que hay supervivencia y, después de la fermentación alcohólica, hay un crecimiento de las poblaciones supervivientes que llevarán a cabo la fermentación maloláctica.
El comienzo de la fermentación maloláctica depende de la temperatura, pH, etanol, etc. La fase de crecimiento toma varios días y aumenta la población hasta 107 ufc/mL. Tan pronto como el ácido málico se transforma completamente en ácido láctico, la población bacteriana comienza a declinar. Si el vino no está sulfitado después de la fermentación maloláctica, estas bacterias permanecen durante meses.
Las bacterias acéticas también pueden estar presentes durante la fermentación alcohólica. Su presencia depende mayoritariamente de la calidad sanitaria de la uva. Uvas podridas, por exceso de lluvias, o contaminadas con Botrytis cinerea producen mostos con poblaciones muy elevadas de acéticas. En el mosto, las especies mayoritarias son Gluconobacter oxydans, Acetobacter aceti y A. pasteurianus, y, en menor medida, Gluconacetobacter liquefaciens y Ga. Hansenii,13 que son las aisladas mayoritariamente también en la uva. Durante la fermentación alcohólica, como consecuencia de las fuertes condiciones de anaerobiosis impuestas por el metabolismo de las levaduras, y la alta dependencia del oxígeno que presentan las acéticas para su desarrollo, las posibilidades de proliferación son prácticamente nulas. Sin embargo, estas bacterias son mucho más resistentes al sulfuroso, bajo pH, etanol, etc., que las bacterias lácticas. De manera que al final de la fermentación alcohólica presentan poblaciones todavía elevadas, que pueden proliferar si las condiciones de almacenamiento o crianza del vino no son las adecuadas, fundamentalmente sulfitado correcto y almacenamiento en atmósferas anaerobias. Al final de la alcohólica, las especies mayoritarias pertenecen al género Acetobacter, por tener estas una mayor facilidad para metabolizar etanol como fuente de carbono, y a diferencia de G. oxydans que prefiere la glucosa inicial del mosto.
En la figura 2 se puede ver un resumen de la evolución de levaduras, bacterias lácticas y acéticas en las fermentaciones alcohólica y maloláctica y durante el almacenamiento del vino.
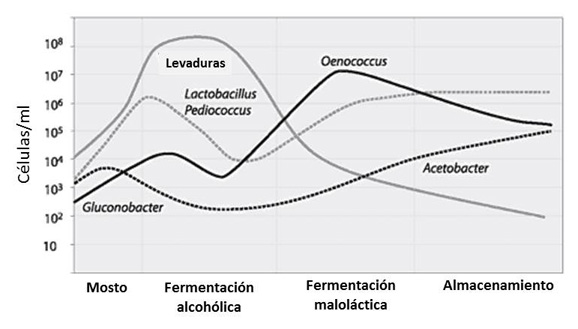
[Fuente: Esta gráfica ha sido adaptada a partir de la publicada por Krieger, 2005]
Alteraciones microbianas durante la fermentación alcohólica
Como hemos visto anteriormente, la fermentación alcohólica es un proceso microbiológico complejo en donde hay un desarrollo secuencial de diferentes especies de levaduras y bacterias. La misma levadura que desarrollándose en un momento concreto de la fermentación puede tener una aportación positiva en el vino, su crecimiento en otras fases puede ser motivo de alteración y de producción de metabolitos indeseables. El ejemplo más claro de este desequilibrio en la dinámica poblacional es el de las diferentes especies de no Saccharomyces, cuyo crecimiento limitado a los primeros días debe ser considerado como positivo para la calidad del vino, pero un desarrollo excesivo y en fases tardías de la fermentación alcohólica, impidiendo una imposición mayoritaria de las cepas de S. cerevisiae, puede tener consecuencias nefastas para la calidad del vino.
Las cepas pertenecientes a los géneros Hansenula, Hanseniaspora, Pichia y Candida tienen un metabolismo oxidativo predominante, pero algunas especies pueden sobrevivir a unos niveles de alcohol muy elevados. Ellas pueden metabolizar los azúcares y ácidos orgánicos en presencia de oxígeno. Algunos subproductos no deseados que resultan de esta actividad son el ácido acético, el acetato de etilo y el acetaldehído, junto con muchos otros compuestos, que si se encuentran presentes a elevada concentración pueden dar lugar a defectos y olores y sabores desagradables en el vino.14
De manera más específica, la levadura apiculada Hanseniaspora uvarum (también conocida como Kloeckera apiculata) es posiblemente la levadura más abundante en los mostos de uva antes de comenzar la fermentación alcohólica y puede crecer rápidamente a bajas temperaturas. En comparación con S. cerevisiae, K. uvarum produce mayor cantidad de acidez volátil y acetato de etilo. Su metabolismo produce otros compuestos volátiles cuya importancia en relación con la calidad del vino no es clara. Además de la producción excesiva de metabolitos indeseables, otro aspecto a tener en cuenta es el de las posibles interacciones negativas que pueden ejercer algunas de estas especies sobre la levadura fermentativa S. cerevisiae. Se considera que las cepas de K. uvarum son la principal razón de la disminución de nitrógeno asimilable, vitaminas y otros micronutrientes en las primeras fases de la fermentación.
«Las cepas de Dekkera/Brettanomyces son probablemente las levaduras contaminantes más temidas por los enólogos (…). Se puede encontrar ya en los mostos.»
Las cepas de Dekkera/Brettanomyces son probablemente las levaduras contaminantes más temidas por los enólogos. A pesar de que este temor está relacionado con el establecimiento de esta levadura en las barricas y la contaminación que produce en los vinos durante la crianza, esta levadura se puede encontrar ya en los mostos. Es cierto que, debido a un metabolismo muy lento, es poco competitiva durante la fermentación alcohólica. A pesar de ello, es una levadura que está bien equipada para sobrevivir a las condiciones más duras de los vinos (alta concentración de alcohol, pH bajo, SO2, etc.) y puede multiplicarse y producir compuestos indeseados que afectarán al vino. Además, la presencia de poblaciones elevadas de Brettanomyces al final de la alcohólica aumenta el riesgo de alteración del vino durante la crianza. Tras la desaparición de S. cerevisiae, esta levadura puede proliferar utilizando aquellos nutrientes no consumidos por Saccharomyces, sobre todo algunos azúcares y fuentes de nitrógeno.
Hasta ahora hemos presentado a las cepas de S. cerevisiae como las agentes imprescindibles durante la fermentación alcohólica, que son capaces de transformar todo el azúcar en etanol, sin producir en contra ningún compuesto negativo. Sin embargo, algunas cepas indígenas, o incluso comerciales, pueden producir cantidades excesivas de ácido acético, compuestos sulfurosos, SO2, urea y sustancias volátiles que pueden ser perjudiciales para la calidad del vino. Algunas cepas silvestres de S. cerevisiae deben ser consideradas como microorganismos contaminantes.14 Las fermentaciones espontáneas suelen llevarse a cabo por una docena de cepas diferentes. A menudo, las cepas que predominan al inicio de la fermentación no son las que completan la degradación de los azúcares. En la misma bodega, en diferentes años se pueden encontrar diferentes cepas de levadura.
Ya he mencionado que las bacterias lácticas presentes en el mosto tienen pocas oportunidades de desarrollarse durante la fermentación alcohólica. Sin embargo, en fermentaciones espontáneas, con problemas de imposición de S. cerevisiae como consecuencia de elevadas poblaciones microbianas en un mosto proveniente de uva muy dañada, puede haber un desarrollo importante de bacterias lácticas. Muchas de las bacterias lácticas que se encuentran en el mosto son heterofermentativas y, por tanto, debe evitarse su desarrollo en la uva y los mostos ya que pueden conducir a la producción de cantidades excesivas de acidez volátil.
La elevada presencia de bacterias lácticas presentes en los mostos procedentes de uvas dañadas, ha sido ampliamente estudiada. Sin ningún tipo de control, estas bacterias pueden crecer muy rápido, consumiendo los azúcares y produciendo una gran cantidad de ácidos láctico y acético como subproductos.14
«A menudo, las cepas que predominan al inicio de la fermentación no son las que completan la degradación de los azúcares.»
El otro momento en que puede haber un desarrollo importante de bacterias lácticas es al final de la fermentación alcohólica. En condiciones normales, con vinos donde la totalidad de los azucares han sido consumidos durante la alcohólica, la principal reacción metabólica llevada a cabo por las bacterias lácticas será la transformación del ácido málico en ácido láctico y CO2, la conocida como fermentación maloláctica. Sin embargo, si se ha producido una parada de fermentación o han quedado azúcares residuales en el vino, el crecimiento de las lácticas de nuevo es muy problemático porque puede llevar a cabo la fermentación heteroláctica, donde además de ácido láctico se producen ácido acético, etanol y CO2, suponiendo un aumento la acidez volátil y produciendo una alteración en el vino conocido como «picado láctico».
Acetobacter y Gluconobacter son los principales géneros de importancia enológica dentro de la familia de las bacterias acéticas. Gluconobacter que se suele encontrarse en las uvas dañadas, degradan los azúcares en ácido acético y otros compuestos, pero tienen una baja resistencia al alcohol. Acetobacter utiliza el etanol como sustrato y lo metaboliza a ácido acético. Ambas bacterias necesitan oxígeno para su actividad. Por tanto, al igual que mencionaba para las lácticas, solo en fermentaciones con un crecimiento lento por parte de las levaduras fermentativas, especialmente de S. cerevisiae, tienen alguna oportunidad para desarrollarse. En el momento se inicia la fermentación alcohólica, la saturación de CO2 en el medio y la falta de oxígeno, impiden su desarrollo. Al final de la fermentación, con los trasiegos de los vinos y un almacenamiento incorrecto (presencia de oxígeno) puede producirse una proliferación importante de las bacterias acéticas que conduciría a un aumento de ácido acético y su éster, acetato de etilo, a partir de azúcares residuales o de etanol, como fuentes de carbonos. Este es el conocido «picado acético».
En definitiva, durante la fermentación alcohólica, las posibilidades de alteraciones por crecimiento microbiano son mucho menos habituales que en otras fases del proceso de elaboración del vino (fermentación maloláctica, crianza, etc.). Así, la diversidad microbiana, especialmente en referencia a las distintas especies de levaduras, bien gestionada a lo largo de la fermentación alcohólica, puede suponer un enriquecimiento del vino en aromas y actividades enzimáticas, que puede resultar en vinos más complejos y con mayor tipicidad, reforzando el concepto de «terroir microbiano».15
Sin embargo, esta misma diversidad no controlada puede conducir a alteraciones en los vinos que disminuirían considerablemente su calidad. Ya he mencionado anteriormente cuál es la dinámica correcta de desarrollo y cómo desviaciones de la misma pueden suponer alteraciones del vino. Una cepa o una especie creciendo en una fase que no toca o con un desarrollo excesivo pueden conducir a la producción de metabolitos indeseables.
La mejor herramienta que dispone el enólogo para el control microbiano de la fermentación alcohólica es, sin ninguna duda, la disponibilidad de levaduras seleccionadas en base a sus características óptimas para el proceso. Esto hace tiempo que es una realidad para la principal especies fermentativa S. cerevisiae y, actualmente, está aumentando la disponibilidad de estas levaduras seleccionadas para otras especies de no Saccharomyces, que serán utilizadas como coinóculos o en inoculaciones secuenciales con S. cerevisiae. Por otra parte, el uso generalizado de estas cepas seleccionadas disminuye el concepto «terroir microbiano» y de la tipicidad, anteriormente mencionado. En consecuencia, se trata de alcanzar un equilibrio entre el control que te aporta la disponibilidad de cepas seleccionadas y la tipicidad y complejidad que aporta de la gran diversidad microbiana a los vinos. Por esta última idea, me he permitido comparar la diversidad microbiana disponible durante la fermentación alcohólica como el yin y el yang para los enólogos.
Bibliografía
1. Pretorius I.S.: Tailoring wine yeast for the new millennium: novel approaches to the ancient art of winemaking. Yeast 2000; 16: 675-729.
2. Fleet G.H., Heard G.M.: Yeasts-growth during fermentation. En G.H. Fleet, G.M. Heard (eds.): Wine Microbiology and Biotechnology. Chur, Suiza: Harwood Academic Publishers, 1993; pp 27-55.
3. Ciani M., Comitini F., Mannazzu I., Dominizio P.: Controlled mixed culture fermentation: a new perspective on the use of non-Saccharomyces yeast in winemaking. FEMS Yeast Res 2010; 10: 123-33.
4. Rojas V., Gil J.V., Piñaga F., Manzanares P.: Acetate ester formation in wine by mixed cultures in laboratories fermentations. Int J Food Microbiol 2003; 86: 181-8.
5. Palomero F., Morata, A., Benito, S., Calderón, F., Suárez-Lepe, J.A.: New genera of yeasts for over-lees aging of red wine. Food Chem 2009; 112: 432-41.
6. González R., Quirós M., Morales, P.: Yeast respiration of sugars by non-Saccharomyces yeast species: A promising and barely explored approach to lowering alcohol content of wines. Trends Food Sci Technol 2013; 29: 35-61.
7. Masneuf-Pomarede I., Bely M., Marullo P., Albertin W.: The genetics of non-conventional wine yeasts: current knowledge and future challenges. Frontiers Microbiol 2016; 6.
8. Romano P., Capece A., Jespersen L.: Taxonomic and ecological diversity of food and beverage yeasts. En: Querol A., Fleet G.H. (eds.): Yeast in Food Beverages. Berlín: Springer, 2006; pp 55-82.
9. Pretorius I.S., van der Westhuizen T.J., Augustyn O.P.H.: Yeast biodiversity in vineyards and wineries and its importance to the South African wine industry. S Afr J Enol Vitic 1999; 20: 61-70.
10. Torija M.J., Rozès N., Poblet M., Guillamón J.M., Mas A.: Yeast population dynamics in spontaneous fermentations: Comparison between two different wine-producing areas over a period of three years. Antonie Van Leeuwenhoek, 2001: 79, 345-52.
11. Goddard, M.R.: Quantifying the complexities of Saccharomyces cerevisiae’s ecosystem engineering via fermentation. Ecology 2008; 89: 2077-82.
12. Salvadó Z., Arroyo-López F.N., Barrio E., Querol A., Guillamón J.M.: Quantifying the individual effects of ethanol and temperature on the fitness advantage of Saccharomyces cerevisiae. Food Microbiol 2011; 28: 1155-61.
13. González A., Hierro N., Poblet M., Rozès N., Mas A., Guillamón J.M.: Application of molecular methods to demonstrate species and strain evolution of acetic acid bacteria population during wine production. Int J Food Microbiol 2005; 102: 295-304.
14. Gianni T.: Contaminación microbiana en el vino. Revista internet de Viticultura y Enología 2009; nº 10/1.
15. Knight S., Klaere S., Fedrizzi B., Goddard M.R.: Regional microbial signatures positively correlate with differential wine phenotypes: evidence for a microbial aspect to terroir. Sci Rep 2015; 5: 14233.