Los compuestos fenólicos son componentes muy importantes del vino puesto que contribuyen en gran medida a sus características sensoriales (por ejemplo, en el color, aroma y astringencia), bien directamente o mediante su interacción con proteínas, polisacáridos u otros compuestos fenólicos.
La composición fenólica del vino depende del tipo de uva utilizada para la vinificación, de la extracción, de los procesos utilizados durante la elaboración del vino y de las reacciones químicas que ocurren durante el envejecimiento del vino.1 Depende de numerosos factores entre los que se encuentran la variedad de uva (blanca o tinta), el modo de estrujado, la posible inclusión o eliminación antes de la fermentación de los hollejos, semillas y pulpa de la uva (especialmente en las variedades tintas), el tipo de vinificación (temperatura y tiempo de maceración) y el envejecimiento. Un mayor tiempo de fermentación con los hollejos, semillas y pulpa permite la extracción de un mayor número de compuestos fenólicos al vino porque el etanol producido actúa como un solvente para la extracción de los fenoles. La composición fenólica también se modifica durante la fermentación por la actividad de las levaduras las cuales son capaces de metabolizar algunos de los compuestos fenólicos presentes. Y en último término, el contacto del mosto y del vino con la barrica de madera también contribuye a la presencia de compuestos fenólicos en el vino. Así, algunos fenoles sencillos, como flavonoides y taninos hidrolizables son extraídos de la madera al vino.1
Los compuestos fenólicos del vino y de las uvas generalmente incluyen derivados de los ácidos hidroxibenzoico e hidroxicinámico, trihidroestilbenos como el cis– y trans-resveratrol, flavonoides, antocianinas y antocianidinas, flavonas y taninos condensados. Los vinos blancos tienen un contenido en compuestos fenólicos inferior que los vinos tintos. Los vinos jóvenes contienen fundamentalmente compuestos fenólicos de pequeño o medio peso molecular. Entre los compuestos fenólicos de bajo peso molecular mayoritarios encontrados en el vino aparecen la catequina, epicatequina, algunas procianidinas, la quercitina, y los ácidos gálico e hidroxicinámico. Los vinos envejecidos en barricas de madera contienen compuestos volátiles responsables de aromas específicos, como vanilina, probablemente extraídos de la madera por el etanol.1
El proceso de fermentación produce cambios cualitativos y cuantitativos en la composición fenólica del vino.1 Al principio de la fermentación alcohólica se produce un rápido descenso en el contenido de compuestos derivados del ácido hidroxicinámico, aunque la velocidad de degradación del ácido cutárico es mayor que la del ácido caftárico. Durante la fermentación, los compuestos derivados del ácido hidroxicinámico se hidrolizan a ácido hidroxicinámico libre, el cual se puede oxidar posteriormente y convertir en fenoles volátiles por acción de las descarboxilasas presentes en las levaduras, o ser adsorbidos por las levaduras. Aproximadamente, el 27,6 % de los ácidos hidroxicinámicos se pierden durante el proceso de vinificación. Según progresa la fermentación, el nivel de antocianinas disminuye debido a la polimerización entre taninos y antocianinas.1
En la mayoría de los vinos tintos se produce un segundo proceso fermentativo, la fermentación maloláctica, llevada a cabo por bacterias lácticas, especialmente Oenococcus oeni, algunas especies de los géneros Lactobacillus (L. plantarum, L. brevis, L. hilgardii, L. buchneri, etc.) y Pediococcus (P. pentosaceus). Los compuestos fenólicos van a influir en el crecimiento de estas bacterias y algunos de ellos van a ser degradados por las bacterias lácticas como consecuencia de su crecimiento en el mosto y vino.2
El conocimiento y estudio de los factores que inciden en la presencia de OTA en vino es esencial para reducir tanto la presencia total como el grado de contaminación en esta bebida tan arraigada social y económicamente.
Efecto de los compuestos fenólicos en el crecimiento y viabilidad de las bacterias lácticas
Se ha descrito que en O. oeni la fermentación maloláctica se estimula en presencia de catequina o quercetina, aunque la presencia de concentraciones crecientes de ácido p-cumárico inhibe dicha fermentación.3 El ácido gálico retrasa o inhibe la formación de ácido acético, lo que puede conducir a un mejor control de la fermentación maloláctica eliminando el aumento en la acidez volátil. Por otro lado, en O. oeni se ha demostrado que los compuestos fenólicos reducen el consumo de azúcares y aumentan el de ácido cítrico, originando un aumento en la producción de ácido acético.4 Vivas et al.5 han demostrado que distintos compuestos fenólicos, como las procianidinas y los taninos de la uva o de la barrica, no ejercen el mismo efecto en O. oeni. Los oligómeros de procianidinas, extraídos de las semillas de la uva, son potentes inhibidores de O. oeni, afectando tanto a su viabilidad como a su crecimiento y a la fermentación maloláctica. Por el contrario, los taninos elágicos favorecen la viabilidad de O. oeni. Estos taninos elágicos cuando se oxidan ejercen un potente efecto inhibitorio, al contrario que las procianidinas las cuales pierden su efecto al oxidarse.
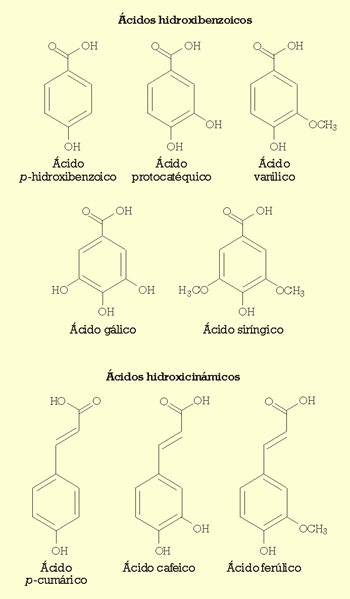
Campos et al.6 han estudiado el efecto de algunos compuestos fenólicos del vino en el crecimiento y viabilidad de cepas de O. oeni y L. hilgardii. La figura 1 muestra los ácidos fenólicos estudiados. Los ácidos hidroxicinámicos son inhibidores más potentes del crecimiento de O. oeni que los ácidos hidroxibenzoicos. Sin embargo, L. hilgardii sólo se inhibe con ácido p-cumárico, mientras que algunos compuestos fenólicos ejercen un efecto positivo en su crecimiento. De manera general, O. oeni es más sensible a la inactivación por los ácidos fenólicos que L. hilgardii.
Se ha estudiado el efecto de diferentes concentraciones de catequina y ácido gálico en el crecimiento y metabolismo de L. hilgardii.7 Estos compuestos fenólicos a las concentraciones que se encuentran normalmente en vino estimulan la velocidad de crecimiento y con ellos se alcanzan unas mayores densidades celulares en la fase estacionaria de crecimiento. Durante las primeras horas de crecimiento, ambos compuestos fenólicos activan la tasa de utilización de glucosa y fructosa, y la catequina aumenta el consumo de ácido málico. Además, en L. hilgardii se ha demostrado que existe una relación directa entre la concentración de fenoles totales en el vino y la pérdida de viabilidad, y entre la capacidad de unión de taninos y la pérdida de viabilidad.8 Estudios recientes indican que L. hilgardii es capaz de metabolizar el ácido gálico y la catequina presentes en el vino,9 mientras que el ácido p-cumárico tiene un efecto negativo en su crecimiento.6 Recientemente, Bossi et al.10 han estudiado la interacción de L. hilgardii con ácido tánico mediante una combinación de estudios fisiológicos y proteómicos. Estos autores han demostrado el efecto inhibitorio del ácido tánico en el crecimiento y han identificado enzimas metabólicas que varían en presencia de ácido tánico.
Salih et al.11 han estudiado el efecto de los ácidos hidroxicinámicos libres o esterificados sobre el crecimiento de L. plantarum. Los resultados obtenidos indican que el crecimiento sólo se ve afectado por los ácidos hidroxicinámicos libres, siendo el ácido ferúlico más inhibidor que el ácido p-cumárico y que el ácido cafeico. Por el contrario, los ésteres, ácido cafeoil-quínico y p-cumaril quínico, al igual que el ácido no fenólico, el ácido quínico, no influye en el crecimiento de L. plantarum. En un medio sintético de laboratorio se observó que el efecto de los ácidos cafeico y ferúlico es dependiente de su concentración y que cantidades bajas de taninos (0,1-0,2 g/L) no inhiben el crecimiento, sin embargo, altas concentraciones (1 g/L) lo retrasan.12 El mecanismo de esta inhibición no está claro. Algunos autores proponen que estos compuestos pueden actuar sobre las proteínas de membrana de las células provocando la salida de una serie de compuestos desde el interior de las células, originando pérdidas de K+, ácido glutámico, RNA intracelular, etc., además de una alteración en la composición de ácidos grasos.12 Otros autores han observado la adsorción de los fenoles sobre las paredes celulares y una alteración de la cubierta celular.13
Puesto que en mostos y vinos se encuentran ácidos hidroxicinámicos y derivados suyos, Stead (1993)14 estudió su posible uso como antimicrobianos para inhibir el crecimiento de bacterias alterantes del vino, como L. brevis y L. collinoides. A concentraciones de 500 y 1000 mg/L, los tres ácidos (p-cumárico, cafeico y ferúlico) inhiben el crecimiento, siendo más eficaces los ácidos cumárico y ferúlico que el ácido cafeico. A concentraciones de 100 mg/L los tres compuestos estimulan el crecimiento de estas bacterias lácticas contaminantes.
Degradación de compuestos fenólicos por bacterias lácticas
Estudios realizados en los años setenta describieron que L. plantarum reduce el ácido quínico (no fenólico), en condiciones anaerobias, hasta ácido dihidroxiciclohexano-carboxílico y ácido acético.15 La ruta constaría de 11 etapas, catalizadas por enzimas inducibles. L. plantarum no sólo reduce ácido quínico, sino que incluso en condiciones anaerobias es capaz de oxidar una proporción de ácido quínico a catecol (1,2-dihidroxifenol), en una ruta que implica la acción de una deshidrogenasa NAD-dependiente y de una descarboxilasa de ácido protocatético (ácido 3,4 dihidroxibenzoico). No se conoce si el ácido dehidrosiquímico es el punto en donde se dividen ambas vías, la oxidativa y la reductora, o bien si el ácido siquímico (no fenólico) se oxida a ácido dehidrosiquímico por acción de una siquimato deshidrogenasa independiente de nucleótidos de piridina.15 Tanto la deshidrogenasa inducible NAD-dependiente como la siquimato deshidrogenasa se han purificado a partir de extractos de L. plantarum.
Los ácidos fenólico carboxílicos (ácidos cumárico y ferúlico) son constituyentes naturales del mosto de uva y vinos. Recientemente, Couto et al.16 han estudiado la capacidad de 35 cepas de bacterias lácticas aisladas de vinos, pertenecientes a 20 especies diferentes, para producir fenoles volátiles a partir de los ácidos cumárico y ferúlico. Los resultados demuestran que 13 cepas (37 %) producen fenoles volátiles a partir de ácido p-cumárico, y sólo tres cepas (9 %) producen 4-etilfenol; el producto final de la ruta metabólica del ácido p-cumárico. La etapa reductiva de esta ruta sólo se encuentra en especies del género Lactobacillus, como L. plantarum, L. brevis y L. collinoides. Siete de las ocho cepas de pediococos estudiados produjeron 4-vinilfenol, pero no 4-etilfenol a partir del ácido p-cumárico. Las dos cepas de O. oeni y una cepa de L. mesenteroides analizadas no produjeron ninguno de los dos derivados del ácido p-cumárico. La capacidad para producir fenoles volátiles a partir de ácido ferúlico es mucho menor que la capacidad para producir fenoles volátiles a partir de ácido p-cumárico.
Previamente, Cavin et al.17 describieron que los ácidos p-cumárico y cafeico son descarboxilados por bacterias de las especies L. brevis, L. plantarum y del género Pediococcus. Esta descarboxilación va acompañada de la formación de fenoles volátiles (4-etilfenol y 4-3 etilguayacol). Sin embargo, O. oeni sólo presenta esta actividad en células permeabilizadas crecidas en presencia de estos compuestos, lo que indica la ausencia de un adecuado sistema de transporte.17
Los ácidos fenólicos derivados del ácido cinámico se encuentran generalmente esterificados con ácido tartárico en los mostos de uva y en los vinos, los cuales por acción de esterasas se pueden liberar como ácidos libres. En L. plantarum se ha descrito que posee dos descarboxilasas de ácidos fenólicos inducibles. Una de ellas, la descarboxilasa de ácido p-cumárico (PDC) ha sido caracterizada molecularmente.18 Recientemente se ha caracterizado el represor transcripcional, PadR, de esta descarboxilasa.19 Esta descarboxilasa metaboliza sólo los ácidos p-cumárico y cafeico en los correspondientes 4-vinil derivados.20 La descarboxilasa PDC se ha expresado en cepas de Saccharomyces cerevisiae para el desarrollo de levaduras vínicas con actividad descarboxilante de ácidos fenólicos.21 Mediante la inactivación del gen que codifica la descarboxilasa PDC se ha comprobado que L. plantarum posee una segunda descarboxilasa inducida preferiblemente por ácido ferúlico,22 la cual permanece sin caracterizar en la actualidad. Además, se ha descrito que L. plantarum posee también una ácido fenólico reductasa inducible, no caracterizada, la cual reduce los ácidos fenólicos a ácidos fenil propiónicos sustituidos, y convierte el ácido p-cumárico en ácido florético. Se ha sugerido que estas actividades inducibles puedan estar implicadas en la respuesta a estrés inducida por los ácidos fenólicos, convirtiéndolos en compuestos menos tóxicos.19

Barthelmebs et al.22 han demostrado que una cepa de Pediococcus pentosaceus aislada de vino, posee una descarboxilasa inducible que ejerce su actividad sobre ácido p-cumárico. La figura 2 muestra que esta proteína es muy similar (85 % idéntica) a la PDC de L. plantarum. Se han construido proteínas quimeras recombinantes intercambiando sus extremos N-terminales. El análisis de las proteínas obtenidas sugiere que la región C-terminal puede estar implicada en determinar la especificidad de sustrato.23
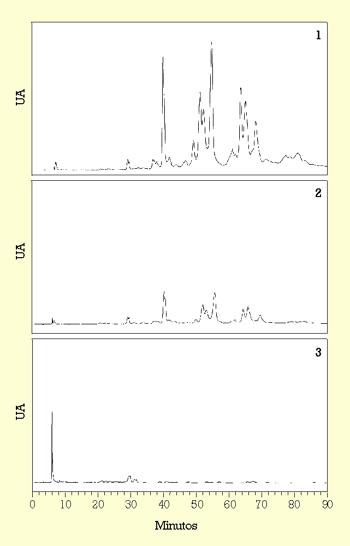
También se ha descrito que entre las bacterias lácticas aisladas de vinos sólo las bacterias de la especie L. plantarum poseen actividad tanasa.24 La enzima tanasa es una hidrolasa que actúa sobre los taninos presentes en el vino, por lo que representa una actividad muy importante en enología por su relación con el color y con fenómenos de enturbiamiento. Tal como muestra la figura 3, extractos de L. plantarum incubados en presencia de ácido tánico producen una degradación gradual de los compuestos que presentan un mayor grado de polimerización hacia unos compuestos de bajo grado de polimerización, hasta obtener fenoles sencillos, como ácido gálico y pirogalol.25 La actividad tanasa de L. plantarum presenta utilidad potencial en la biodegradación y en el aprovechamiento de los compuestos fenólicos presentes en los residuos generados por la industria vitivinícola.
Por otro lado, se ha observado que durante el envejecimiento del vino en las barricas se produce un aumento del compuesto vanilina, un potente aromatizante. Esto sugiere la existencia en el vino de compuestos precursores de vanilina, los cuales pueden ser modificados por las bacterias lácticas. Recientemente, Bloem et al.26 han estudiado la capacidad de las bacterias lácticas del vino para metabolizar algunos compuestos fenólicos precursores de vanilina. En este estudio se demuestra que las bacterias lácticas no son capaces de formar vanilina a partir de eugenol, isoeugenol o ácido vanílico. Sin embargo, algunas bacterias lácticas reducen vanilina al correspondiente vanilil alcohol. Los resultados obtenidos no explican las concentraciones de vanilina observadas durante el crecimiento de las bacterias lácticas en contacto con las barricas de madera.
De lo anteriormente expuesto se deduce que todavía faltan muchos aspectos por conocer respecto a la relación entre compuestos fenólicos y bacterias lácticas del vino. Fundamentalmente, es necesario conocer aspectos moleculares tanto en el ámbito de los genes como de los enzimas implicados en la degradación de estos compuestos. Del mismo modo, es necesario conocer las bases moleculares del mecanismo de acción de los compuestos fenólicos en la inhibición del crecimiento de las bacterias lácticas. Nuestro grupo, en la actualidad, está estudiando estos aspectos, con objeto de elucidar los mecanismos moleculares implicados.
Agradecimientos
Los autores agradecen la financiación recibida del Ministerio de Ecuación y Ciencia (CICYT, AGL2005-00470), del Instituto Nacional de Investigación y Tecnología Agraria y Alimentaria (INIA, RM03-002) y de la Comunidad de Madrid (CAM, 07G/0035/2003).
Bibliografía
1 Shahidi, F. y Naczk.: «Phenolic compounds of beverages». En: Phenolics in Food and Nutraceuticals, CRC Press (2004).
2 Muñoz, R.; Moreno-Arribas, M.V. y de las Rivas, B.: «Bacterias Lácticas». En: Microbiología del vino. Carrascosa, A.. V., Muñoz, R. y González, R. (coordinadores), AMW Ediciones, pp. 231-272 (2005).
3 Reguant, C.; Bordons, A.; Arola, L. y Rozès, N.: «Influence of phenolic compounds on the physiology of Oenococcus oeni from wine». J Appl Microbiol 2002; 88: 1065-1071.
4 Rozès, N.; Arola, L. y Bordons, A.: «Effect of phenolic compounds on the co-metabolism of citric acid and sugars by Oenococcus oeni from wine», Lett Appl Microbiol (2003); 36: 337-341.
5 Vivas, N.; Augustin, M. y Lonvaud-Funel, A.: «Influence of oak wood and grape tannins on the lactic acid bacterium Oenococcus oeni (Leuconostoc oenos, 8413)», J Sci Food Agric 2000; 80: 1675-1678.
6 Campos, F.M.; Couto, J.A. y Hogg, T.A.: «Influence of phenolic acids on growth and inactivation of Oenococcus oeni and Lactobacillus hilgardii», J Appl Microbiol 2003; 94: 167-174.
7 Alberto, M.R.; Farías, M.E. y Manca de Nadra, M.C.: «Effect of gallic acid and catechin on Lactobacillus hilgardii 5w growth and metabolism of organic compounds», J Agric Food Chem 2001; 49: 4359-4363.
8 Alberto, M.R.; Farías, M.E. y Manca de Nadra, M.C.: «Effect of wine phenolic compounds on Lactobacillus hilgardii 5w viability», J Food Prot 2002; 65: 211-213.
9 Alberto, M.R.; Gómez-Cordovés, M.C. y Manca de Nadra, M.C.: «Metabolism of gallic acid and catequin by Lactobacillus hilgardii from wine», J Agric Food Chem 2004; 52: 6465-6469.
10 Bossi, A.; Rinalducci, S.; Zolla, L.; Antonioli, P.; Righetti P.G. y Zapparoli, G.: «Effect of tannic acid on Lactobacillus hilgardii analysed by a proteomic approach», J Appl Microbiol 2007; 102: 787-795.
11 Salih, A.G.; Le Querré, J.M. y Drilleau, J.F.: «Action des acides hydroxycinnamiques libres et estérifiés sur la croissance des bactéries», Sci Aliments 2000; 20: 537-560.
12 Rozès, N. y Peres, C.: «Effects of phenolic compounds on the growth and the fatty acid composition of Lactobacillus plantarum», Appl Microbiol Biotechnol 1998; 49: 108-111.
13 Ruiz-Barba, J.L.; Rios-Sánchez, R.M.; Fedriani-Triso, C.; Olias, J.M.; Rios, J.L. y Jiménez-Diaz, R.: «Bactericidal effects of phenolic compounds from green olives against Lactobacillus plantarum»; Syst Appl Bacteriol 1990; 13: 199-205.
14 Stead, D.: «The effect of hydroxycinnamic acids on the growth of wine-spoilage lactic acid bacteria», J Appl Bacteriol 1993; 75: 135-141.
15 Whiting, G.C.: «Some biochemical and flavour aspects of lactic acid bacteria in ciders and other alcoholic beverages». En: Lactic acid bacteria in beverages and food. Carr, J.G., Cutting, C.V. y Whiting, G.C. (Ed.). Academic Press, pp 69-85 (1975).
16 Couto, J.A.; Campos, F.M.; Figuereido, A.R. y Hogg, T.A.: «Ability of lactic acid bacteria to produce volatile phenols», Am J Enol Vitic 2006; 57: 166-171.
17 Cavin, J.F.; Andioc, V.; Etievant, P.X. y Diviès, C.: «Ability of wine lactic acid bacteria to metabolize phenol carboxylic acids», Am J Enol Vitic 1993; 44: 76-80.
18 Cavin, J.F.; Barthelmebs, L. y Diviès, C.: «Molecular characterization of an inducible p-coumaric acid decarboxylase from Lactobacillus plantarum: gene cloning, transcriptional analysis, overexpression in Escherichia coli, purification, and characterization», Appl Environ Microbiol 1997; 63: 1939-1944.
19 Gury, J.; Barthelmebs, L.; Tran, N.P.; Diviès, C. y Cavin, J.F.: «Cloning, deletion, and characterization of PadR, the transcriptional repressor of the phenolic acid decarboxylase-encoding padA gene of Lactobacillus plantarum», Appl Environ Microbiol 2004; 70: 2146-2153.
20 Cavin, J.F.; Barthelmebs, L.; Guzzo, J.; Van Beeumen, J.; Samyn, B.; Travers, J.F. y Diviès, C.: «Purification and characterization of an inducible p-coumaric acid decarboxylase from Lactobacillus plantarum», FEMS Microbiol Lett 1997; 147: 291-295.
21 Smit, A.; Cordero Otero, R.R.; Lambrechts, M.G.; Pretorius, I.S. y Van Rensburg, P.: «Enhancing volatile phenol concentrations in wine by expressing various phenolic acid decarboxylase genes in Saccharomyces cerevisiae», J Agric Food Chem 2003; 51: 4909-4915.
22 Barthelmebs, L.; Diviès, C. y Cavin, J.F.: «Knockout of the p-coumarate decarboxylase gene from Lactobacillus plantarum reveals the existence of two other inducible enzymatic activities involved in phenolic acid metabolism», Appl Environ Microbiol 2000; 66: 3368-3375
23 Barthelmebs, L.; Diviès, C. y Cavin, J.F.: «Expression in Escherichia coli of native and chimeric phenolic acid decarboxylases with modified enzymatic activities and method for screening recombinant E. coli strains expressing these enzymes», Appl Environ Microbiol 2001; 67: 1063-1069.
24 Vaquero, I.; Marcobal, A. y Muñoz, R.: «Tannase activity by lactic acid bacteria isolated from grape must and wine», Int J Food Microbiol 2004; 96: 199-204.
25 Rodríguez, H.; Gómez-Cordovés, C.; de las Rivas, B. y Muñoz, R.: «Degradación de taninos gálicos mediante extractos de Lactobacillus plantarum», Congreso BioSpain Biotec2006, Madrid (2006).
26 Bloem, A.; Bertrand, A.; Lonvaud-Funel, A. y De Revel, G.: «Vanillin production from simple phenols by wine-associated lactic acid bacteria», Lett Appl Microbiol 2007; 44: 62-67.