Desde el punto de vista de la microbiología enológica, y asociados al cambio climático, las variaciones previstas en las condiciones ambientales (temperatura, estrés hídrico, etc.), en la composición del sustrato, o incluso en la fisiología de la baya y en las técnicas de cultivo, hacen probable que se modifiquen la ecología, la biodiversidad y el metabolismo de la microbiota de la viña, la uva, el mosto y el vino. Uno de los aspectos de este problema que más inquieta a los productores es que, para alcanzar la madurez fenólica apropiada, el contenido en azúcar de la uva y el grado alcohólico esperado irán probablemente en aumento, dando lugar a dos situaciones potencialmente negativas, en función también de otros factores, como el estilo de vinificación.
Por un lado está la posibilidad de fermentaciones incompletas, si se supera el nivel de tolerancia al etanol de las levaduras predominantes durante el proceso de fermentación (que en principio serán células de la cepa utilizada como cultivo iniciador), dando lugar a vinos con exceso de azúcar residual, microbiológicamente inestables y sensorialmente defectuosos. La situación recíproca, en el caso de que la fermentación sea completa, sería una producción excesiva de etanol, que además de constituir una limitación para la calidad sensorial del vino, lo es también para su viabilidad comercial. Como otras muchas cuestiones en vitivinicultura, el problema del excesivo grado alcohólico del vino puede ser abordado desde diferentes puntos de vista y recurriendo a diferentes disciplinas (viticultura, microbiología, tecnología, biotecnología ) de una manera complementaria. En este artículo vamos a discutir fundamentalmente la posibilidad de reducir la producción de etanol durante la fermentación alcohólica, recurriendo a la microbiología y la biotecnología microbianas, en concreto mediante la selección y desarrollo de cepas de Saccharomyces con bajo rendimiento alcohólico.
La variabilidad natural de Saccharomyces
Existen numerosos determinantes genéticos, ambientales y fisiológicos que afectan a la producción de etanol por parte de las levaduras durante la fermentación alcohólica. Saccharomyces cerevisiae parece haberse adaptado a lo largo de su evolución para optimizar su tasa de crecimiento en ambientes ricos en nutrientes fácilmente asimilables como azúcares y aminoácidos. Algunas características de esta levadura que forman parte de su adaptación a este nicho particular son el hecho de que S. cerevisiae pueda metabolizar la glucosa y la fructosa tanto por vía respirativa como por vía fermentativa, y de crecer en condiciones aerobias o anaerobias. Todo ello hace que esta especie presente algunas particularidades metabólicas, como el efecto Pasteur y el efecto Crabtree y, fundamentalmente, esta última debe ser tenida en cuenta a la hora de estudiar y tratar de modificar la producción de etanol durante la fermentación.
El efecto Crabtree se ha descrito en S. cerevisiae y un número limitado de otras levaduras y hace que en presencia de cantidades de glucosa relativamente bajas, aún en presencia de cantidades suficientes de oxígeno, gran parte del azúcar consumido se destine a la producción de etanol mediante la vía fermentativa. Una de las explicaciones propuestas para este fenómeno es que en presencia de glucosa se alcanzan grandes concentraciones de piruvato intracelular, lo que favorece su degradación por la vía de la piruvato descarboxilasa (fig.1), un enzima con gran capacidad de carga y alta Km, en lugar del complejo piruvato deshidrogenasa, que lleva directamente a acetil CoA. Puesto que la capacidad de las reacciones posteriores que permitirían la transformación del acetaldehído formado por la piruvato descarboxilasa en acetil-CoA es limitada, esto favorece finalmente la formación de etanol aún en condiciones aeróbicas.
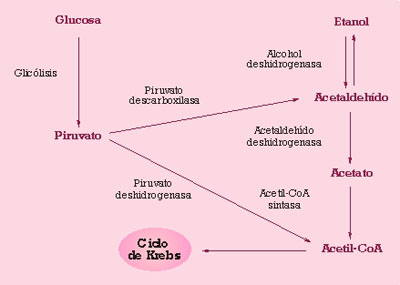
En la utilización preferente de la vía fermentativa en presencia de grandes cantidades de hexosas parece que también podrían jugar un papel los fenómenos de represión por catabolito de carbono, aunque en algunos casos los datos experimentales no son del todo concluyentes. La represión por catabolito de carbono es un fenómeno común a muchos microorganismos por el cual la transcripción de los genes implicados en la utilización de fuentes de carbono alternativas está reprimida en presencia de azúcares represores, fundamentalmente la glucosa y la fructosa, que son metabolizadas con mejor eficiencia. Variaciones en la composición de un medio tan complejo como el mosto, en la adición de sulfitos o de aditivos van a afectar también la producción de etanol a través de diversos mecanismos metabólicos. La naturaleza y abundancia de las fuentes de nitrógeno también pueden tener efecto sobre los productos mayoritarios de la fermentación.
La forma más sencilla de explotar enológicamente la variabilidad natural de S. cerevisiae ha consistido en la selección de cepas específicas mediante aislamientos a partir de uva o de mostos en diferentes fases de fermentación. Esta estrategia es utilizada aún de manera extensiva, y en prácticamente todas las regiones vitivinícolas del mundo se ha procedido o se está procediendo al aislamiento y caracterización de cepas autóctonas, con el fin de utilizarlas como levadura seca activa.2 Entre los criterios de selección tradicionales para cepas vínicas el poder fermentativo ocupaba un papel preponderante hasta hace poco tiempo. Sin embargo, ante la nueva situación planteada por el cambio climático, sería deseable la selección de cepas de Saccharomyces con un poder fermentativo más moderado, al menos en términos de rendimiento en etanol. Por lo tanto una fuente de nuevas cepas para vinificación, mejor adaptadas a la nueva situación podría seguir siendo la selección de cepas de origen natural, pero con nuevos criterios de selección, más adecuados a la situación y los estilos de vinificación actuales.
Sin embargo, muchos consideran que la variabilidad natural de S. cerevisiae para el carácter «producción de etanol» se considera bastante baja. Además, el uso extendido de levadura seca activa dificulta la tarea de identificar nuevas cepas naturales a partir de microorganismos aislados en las bodegas. Como elemento positivo está el hecho de que en nuestro país se conservan diversas colecciones de cepas de levaduras enológicas, fruto de procesos previos de selección o de estudios de campo, que podrían constituir una fuente de cepas ya caracterizadas como base para un proceso de selección menos azaroso.
La selección genética clásica
Una alternativa a la selección de cepas de levadura completamente nuevas consiste en la mejora genética de cepas que ya han sido seleccionadas previamente y que están incluso en uso, con el fin de, conservando las propiedades iniciales por las que han sido seleccionadas, alterar el rendimiento en la producción de etanol. Por este motivo diversos grupos de investigación de todo el mundo recurren a la mejora genética de cepas enológicas, ya existentes y de eficacia comprobada, para obtener nuevas cepas con propiedades mejoradas.2,5
En comparación con otros microorganismos de uso industrial, la mejora genética clásica ha sido poco explotada para la modificación de levaduras vínicas, en parte por las dificultades derivadas de las características genéticas y la estructura genómica de estas levaduras (aneuploidías, carencia de marcadores genéticos). Algunos ejemplos de aplicación exitosa en enología son la mutagénesis al azar y la hibridación sexual, tanto mediante el método tradicional como mediante la técnica de «rare-mating».2,4,6 Se trata de dos técnicas que han sido utilizadas anteriormente con éxito para la mejora genética de levaduras industriales.7 En comparación con la ingeniería genética o la fusión artificial de protoplastos, estas dos técnicas presentan la ventaja de ser ampliamente aceptadas en el entorno social y enológico y de no estar sometidas a restricciones de uso y comercialización como lo están los organismos genéticamente modificados (OGM).
Para cualquiera de estos métodos no dirigidos, desde la selección de cepas naturales, pasando por la mutagénesis al azar y la hibridación sexual, la reducción de la producción de etanol como criterio de selección tiene la desventaja de constituir un fenotipo que no es fácil de seleccionar. Procedimientos como la mutagénesis o la hibridación dan lugar a un gran número de células viables, muchas de las cuales no difieren de la cepa original en el carácter deseado, en este caso producción de etanol, y sólo una proporción muy baja (a veces menos de una por millón) tendrá mejorado el carácter deseado. Tampoco hay que perder de vista que la producción de etanol es un carácter cuantitativo que muchos genes y proteínas, de modo que muchas de las mutaciones potencialmente interesantes tendrán un efecto mínimo por sí mismas en la producción de etanol, siendo necesaria la acumulación de diversas mutaciones para obtener efectos apreciables. Lamentablemente, aún esas pocas cepas mejoradas pueden ser portadoras de otras mutaciones que hagan que la cepa no sea útil desde el punto de vista enológico.
Tabla 1 Diferentes alternativas para la obtención de cepas de S. cerevisiae con bajo rendimiento alcohólico
| Método de mejora | Ventajas | Limitaciones |
| Aislamiento de cepas naturales | Técnicamente sencillo Existen colecciones |
No aprovecha características previamente seleccionadas |
| Variabilidad natural limitada | ||
| Hibridación sexual | Sin restricciones legales o comerciales | No hay buenos criterios de selección para baja producción de etanol |
| Puede aportar bastante variabilidad | Estabilidad genética | |
| Compatibilidad sexual y capacidad de esporulación de las cepas | ||
| Poca variabilidad de partida para la producción de etanol | ||
| Necesidad de retrocruzamientos | ||
| Mutagénesis | Sin restricciones legales o comerciales | No hay buenos criterios de selección para baja producción de etanol |
| Técnicamente sencillo | Aporta variabilidad limitada | |
| Trabajo sobre cepas con propiedades contrastadas | Estabilidad genética | |
| Ingeniería genética | Método muy dirigido | OGM |
| Trabajo sobre cepas con propiedades contrastadas | Las consecuencias de la modificación no son siempre las esperadas (se necesitan varias modificaciones por cepa) | |
| Relativamente complejo | ||
| Fusión de protoplastos | Poco limitado por la barrera de especie | OGM Estabilidad de los híbridos |
| Aporta gran variabilidad |
Esta baja frecuencia de aparición de mutantes interesantes, junto con la dificultad para su selección, es probablemente una de las principales limitaciones de los métodos clásicos de mejora genética al menos en el caso particular de la baja producción de etanol. Para solventarlo se hace necesario desarrollar criterios de selección que, teniendo cierto poder predictivo sobre la producción de etanol de la cepa correspondiente, sean fáciles de seleccionar sin necesidad de un análisis individualizado, por ejemplo mediante al detección de colonias que crecen en determinados medios o dan lugar a la aparición de un color característico. Algunos de los criterios posibles son una mayor producción de biomasa o de productos secundarios de la fermentación, como el glicerol. La mayor producción de biomasa puede estar asociada con una pared celular más gruesa, y por tanto con una mayor tolerancia a determinados inhibidores del crecimiento como rojo congo, calcofluor, o cafeína. También podría encontrarse una mayor producción de biomasa asociada a la acumulación de más carbohidratos de reserva, como glucógeno, que se puede poner de manifiesto mediante tinciones específicas. En cualquier caso, se trata de caracteres de tipo gradual y con una relación indirecta con el que realmente interesa.
Además, los mutantes, o las cepas obtenidas de los cruzamientos pueden ser genéticamente inestables por diversos motivos, dando lugar a la pérdida del carácter seleccionado o de otras propiedades enológicas interesantes, por lo que la estabilidad es uno de los rasgos más importantes que hay que verificar en las cepas obtenidas. Otra limitación de los métodos de selección, cuando se trata de manipular una gran cantidad de cepas independientes, es que es difícil reproducir a pequeña escala las condiciones de fermentación industrial, esto puede llevar por ejemplo, a seleccionar una cepa con menor producción de etanol, como consecuencia de un efecto Crabtree menos acusado, pero que en condiciones de limitación de oxígeno tendría un comportamiento similar al de la cepa que se trataba de mejorar.
Por último, como se ilustra más adelante en el caso de cepas mejoradas por ingeniería genética, hay que considerar el destino de los azúcares del mosto en las fermentaciones con estas cepas y sus consecuencias para la calidad del vino, ya que pueden no consumirse totalmente, transformarse en biomasa, carbohidratos de reserva, glicerol, o productos no deseados de la fermentación. En el caso de la hibridación sexual hay que considerar además las limitaciones derivadas de la poca variabilidad natural aparente que ya se ha comentado en cuanto a la producción de etanol por S. cerevisiae, lo que limita la elección de cepas parentales para el cruzamiento. Además, al combinar genomas muy diferentes (como ocurre en el caso de la fusión de protoplastos), es difícil predecir las consecuencias de la combinación y puede ser necesario llevar a cabo varios retrocruzamientos para recuperar las características enológicas de alguna de las cepas de partida.
|
La ingeniería genética La ingeniería genética constituye la alternativa más obvia a la mejora genética clásica para mejorar cepas de levadura vínica industrial. De hecho, en la actualidad se comercializa en los Estados Unidos una cepa recombinante capaz de catalizar la descarboxilación del ácido málico. En lo que concierne a la producción de etanol, se han desarrollado diversos proyectos de ingeniería metabólica con el fin de alterar las proporciones de los diversos metabolitos que se obtienen durante la fermentación de los azúcares del mosto,2,4 incluyendo una disminución de la producción de etanol.8-10 Uno de los objetivos a los que se han consagrado más esfuerzos es aumentar la producción de glicerol a costa de la de etanol mediante la superexpresión del gen GPD1 (glicerol-3-fosfato deshidrogenasa), sin embargo las restricciones que impone el equilibrio redox de la célula han hecho que necesarias diversas modificaciones genéticas adicionales con el fin de compensar el aumento concomitante de la acidez volátil y otros productos secundarios de la fermentación, además de alteraciones en las condiciones de fermentación.11,12 Además, esta estrategia presenta el inconveniente de que las levaduras obtenidas serían consideradas OGM por la legislación europea, lo que acarrearía una importante serie de limitaciones a su uso y comercialización, sin menospreciar el efecto de que sería necesario un etiquetado específico, además de que la OIV no ha aceptado todavía la utilización enológica de los OGM. La fusión de protoplastos es otro método de mejora genética sobre el que existen varios ejemplos de uso exitoso para mejorar las propiedades de cepas industriales de Saccharomyces 6 y que podría llegar a ser interesante en este contexto, sin embargo la actual legislación europea también considera los organismos así obtenidos como OGM, por lo que comparten las limitaciones de las cepas mejoradas por ingeniería genética. |
En conclusión, y a pesar de todas las limitaciones de la mejora genética clásica comentadas anteriormente, la mutagénesis y la hibridación sexual son en este momento dos de las estrategias más prometedoras para la obtención de cepas enológicas de levadura con producción reducida de etanol.
Bibliografía
1. Pronk, J.T.; Steensma, H.Y. y van Dijken, J.P.: «Pyruvate metabolism in Saccharomyces cerevisiae », Yeast 1996; 12 (16): 1607-1633.
2. Pretorius, I.S.: «Tailoring wine yeast for the new millennium: novel approaches to the ancient art of winemaking», Yeast 2000; 16 (8): 675-729.
3. Querol, A. y Ramon, D.: «The application of molecular techniques in wine microbiology», Trends in Food Science & Technology 1996, 7 (3): 73-78.
4. Bisson, L.F.: «Biotechnology of wine yeast», Food Biotechnology 2004, 18(1): 63-96.
5. Cebollero, E.; González-Ramos, D.; Tabera, L. y González, R.: «Transgenic wine yeast technology comes of age: is it time for transgenic wine?», Biotechnology Letters 2007; 29 (2): 191-200.
6. Spencer, J.F.T; Spencer, D.M.; Whittingtonvaughan, P. y Miller, R.: «Use of mitochondrial mutants in the isolation of hybrids involving industrial yeast strains .4. Characterization of an intergeneric hybrid, Saccharomyces-diastaticus x Hansenula-capsulata , obtained by protoplast fusion», Current Genetics 1983, 7 (2): 159-164.
7. González, R.; Martínez-Rodríguez, A.J. y Carrascosa, A.V.: «Yeast autolytic mutants potentially useful for sparkling wine production», International Journal of Food Microbiology 2003; 84 (1): 21-26.
8. Remize, F.; Roustan, J.L.; Sablayrolles, J.M.; Barre, P. y Dequin, S.: «Glycerol overproduction by engineered Saccharomyces cerevisiae wine yeast strains leads to substantial changes in by-product formation and to a stimulation of fermentation rate in stationary phase», Applied and Environmental Microbiology 1999; 65 (1): 143-149.
9. Michnick, S.; Roustan, J.L.; Remize, F.; Barre, P. y Dequin, S.: «Modulation of glycerol and ethanol yields during alcoholic fermentation in Saccharomyces cerevisiae strains overexpressed or disrupted for GPD1 encoding glycerol 3-phosphate dehydrogenase», Yeast 1997; 13 (9): 783-793.
10. Eglinton, J.M.; Heinrich, A.J.; Pollnitz, A.P.; Langridge, P.; Henschke, P.A. y Lopes, M.D.: «Decreasing acetic acid accumulation by a glycerol overproducing strain of Saccharomyces cerevisiae by deleting the ALD6 aldehyde dehydrogenase gene», Yeast 2002; 19 (4): 295-301.
11. Cambon, B.; Monteil, V.; Remize, F.; Camarasa, C. y Dequin, S.: «Effects of GPD1 overexpression in Saccharomyces cerevisiae commercial wine yeast strains lacking ALD6 genes», Applied and Environmental Microbiology 2006; 72 (7): 4688-4694.
12. Heux, S.; Sablayrolles, J.M.; Cachon, R. y Dequin, S.: «Engineering a Saccharomyces cerevisiae wine yeast that exhibits reduced ethanol production during fermentation under controlled microoxygenation conditions», Applied and Environmental Microbiology 2006; 72 (9): 5822-5828.






