Cada variedad de vid es el resultado de la propagación mediante esqueje o injerto, de una planta fundadora que surgió de la germinación de una semilla. Si consideramos las variedades que se mencionan en los tratados antiguos de agricultura y suponemos que algunos nombres varietales han llegado reconocibles hasta nuestros días, podríamos estimar que muchas de las variedades actuales llevan en cultivo entre dos siglos y dos milenios. Cabe preguntarse cómo, a lo largo de los siglos, estas variedades han podido adaptarse a los cambios climáticos que sin duda se han producido, así como a los cambios en el manejo del cultivo, las necesidades de los viticultores y los requerimientos del mercado.
Las variedades de vid y el origen de la variación somática
A pesar de que la propagación por esquejes es una estrategia conservadora para producir plantas que sean idénticas a sus progenitoras, con el tiempo se producen espontáneamente variaciones morfológicas y fisiológicas en los sarmientos. En muchos casos, esta variación es estable y puede propagarse por esquejes o injertos, lo que indica que tiene su origen en cambios moleculares o mutaciones endógenas que afectan a la codificación y a la expresión de la información genética. Es lo que se conoce como variación somática, ya que esta variación no se genera mediante el proceso de recombinación asociado a la reproducción sexual, sino por la aparición de mutaciones asociadas a la proliferación celular en el cuerpo o soma de la planta.
Las mutaciones somáticas se producen espontáneamente en cada división celular que tiene lugar en los meristemos o zonas de crecimiento de la planta que se localizan en las yemas y en los ápices de los sarmientos (fig. 1). Estas mutaciones se transmiten a todas las células hijas de la célula mutante original. Dada la estructura de la planta, si la célula que sufre la mutación está en la capa celular externa del meristemo (capa L1), las células hijas ocuparán esta capa que da lugar a la epidermis de la planta. Si la célula mutante original forma parte de la capa celular interna del meristemo (capa L2) las células hijas ocuparán esta posición en el resto de la planta o en plantas derivadas. Ocasionalmente una célula de una capa celular puede colonizar otra capa.
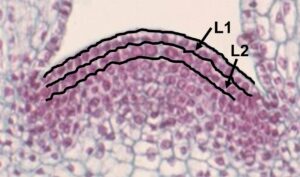
Las plantas en las que las dos capas L1 y L2 son genéticamente distintas se denominan quimeras y es la situación más común en las variedades de vid como consecuencia de la acumulación de mutaciones de manera independiente en cada capa. También es importante considerar que la vid, al igual que otros muchos organismos superiores, posee dos genomas (uno materno y otro paterno) y con ello dos copias de cada gen (es un organismo diploide). Las mutaciones, al ser sucesos únicos, siempre afectan a una de las copias.
Cuanto más antigua es una variedad, o cuanto más ciclos de multiplicación sufre, más posibilidades existen de que aparezcan mutaciones. La mayor parte de estas mutaciones no tienen efecto alguno en el fenotipo o aspecto del sarmiento o de la planta. Solo una pequeña proporción provoca cambios visibles y en algunos casos estos cambios pueden tener relevancia vitícola.1 En la historia del cultivo de la vid, la variación somática ha contribuido a mejorar y diversificar muchos caracteres productivos de la planta, así como a su adaptación a distintas zonas de cultivo. Esta variación es la base de la selección masal que se produce cuando los viticultores seleccionan las plantas más productivas y mejor adaptadas para ampliar o replantar sus viñedos. También es la base de la selección clonal que consiste en la identificación de plantas que reúnan las mejores características productivas y su amplificación en vivero.2
A veces, la variación somática genera cambios cualitativos que afectan a caracteres muy conspicuos como el color, el aroma de la uva o la ausencia de semillas, a partir de los cuales se han desarrollado nuevas variedades derivadas.1
Ejemplos de ello son las variedades pinot blanc, pinot gris o pinot meunier derivadas de pinot noir3 o la variedad tempranillo blanco, originada por mutación de tempranillo en la Denominación de Origen Calificada Rioja (véase el artículo de Juana Martínez y Enrique García-Escudero en este mismo dossier) recientemente incorporada al registro de variedades.
Nuevas herramientas moleculares para la detección de variación somática
En el año 2001, no existía información sobre el origen de la variación somática en la vid. Cabía pensar que la variación espontánea observada entre distintas plantas o sarmientos se debía a mutaciones somáticas. Sin embargo, en ningún caso se habían identificado estas mutaciones. El conocimiento de la información genética que contienen los genomas de las plantas gracias a las técnicas de secuenciación del DNA ha acelerado la investigación en biología vegetal. La primera secuencia completa del genoma de una planta (Arabidopsis thaliana) se publicó en el año 2000 y el cuarto genoma secuenciado fue el de la vid publicado en 2007.4
A partir de 2010, se ha producido una extraordinaria mejora de las tecnologías de secuenciación de genomas que han reducido los tiempos requeridos y han abaratado su uso. Paralelamente, el desarrollo de herramientas bioinformáticas para el análisis de los datos obtenidos mediante esta secuenciación masiva permite detectar y cuantificar los cambios o mutaciones que se producen en las secuencias. Estas herramientas permiten también abordar el estudio de la expresión génica en el genoma completo y conocer qué nivel de actividad tiene cada uno de los genes del genoma en un órgano de la planta, en un momento del desarrollo o ante unas condiciones ambientales determinadas.
Causas moleculares de la variación somática
Hasta el momento las mutaciones somáticas identificadas en vid pertenecen a tres tipos diferentes: mutaciones puntuales, inserciones de elementos transponibles y cambios estructurales. A continuación se describen algunas de las variantes somáticas de vid mejor caracterizadas a escala molecular.
Mutaciones puntuales
Tanto el fenotipo de la variedad pinot meunier (entrenudos cortos y aumento de vellosidad en las hojas) como el aroma moscatel se producen en la vid como consecuencia de mutaciones puntuales. En el caso de pinot meunier, variedad derivada de pinot noir, Boss y Thomas5 hipotetizaron que su aspecto podría deberse a una alteración en la respuesta a las giberelinas, hormonas vegetales responsables de la elongación de los entrenudos y que también afectan a la densidad de pelos en las hojas.
«El análisis de la herencia del aroma moscatel había demostrado que está determinado, en gran parte, por una zona del cromosoma 5.»
La secuenciación en ambas variedades del gen VviGAI, que codifica una proteína que reprime la respuesta a giberelinas en la vid, permitió identificar una mutación puntual en su secuencia que provoca un cambio de un aminoácido en la proteína correspondiente. Este pequeño cambio en la proteína explica el fenotipo observado en pinot meunier. Boss y Thomas demostraron también que pinot meunier es una quimera periclinal en la que la mutación solo está presente en las células epidérmicas que derivan de la capa meristemática más externa (L1).5 Aunque la mutación únicamente está presente en una de las dos copias del gen es suficiente para producir el fenotipo mutante, lo que indica que se trata de una mutación dominante.
Mutaciones puntuales con efecto dominante son también las causantes del aroma moscatel que se produce en algunas variedades de vid como consecuencia de la acumulación de compuestos terpénicos. El análisis de la herencia del aroma moscatel6 había demostrado que está determinado, en gran parte, por una zona del cromosoma 5. La inspección de la secuencia del genoma de la vid en esa zona identificó la presencia del gen DXS que podría ser responsable de esta variación aromática. Este gen codifica el enzima 1-deoxi-D-xilulosa-5P sintasa que cataliza el primer paso en la ruta de síntesis de terpenos. De hecho, todas las variedades con aroma moscatel presentan mutaciones puntuales que alteran específicamente una región de esta proteína.7 Algunos de estos cambios se han relacionado con un aumento de la actividad catalítica del enzima que provocaría los elevados niveles de acumulación de terpenos aromáticos que se observan en estas variedades.8
Inserciones de elementos transponibles
Los elementos transponibles son secuencias génicas que tienen capacidad de moverse de forma autónoma o semiautónoma por el genoma. Su inserción o escisión en distintas posiciones provoca mutaciones en la secuencia del DNA y estas mutaciones ocasionan a veces cambios fenotípicos. El genoma de la vid es muy rico en elementos transponibles. Sin embargo, hasta el momento solo se han descrito dos variantes somáticas espontáneas sin interés comercial provocadas por nuevas inserciones de estos elementos en la vid, concretamente en las variedades carignan noir (mazuelo) y trebbiano toscano (ugni blanc). En el caso de mazuelo, existe una variante conocida con las siglas RRM (Reiterated Reproductive Meristems), por la reiteración que presentan sus meristemos reproductivos, que muestra un gran incremento del tamaño de inflorescencias, zarcillos y racimos (fig. 2). Los análisis genéticos determinaron que este fenotipo es dominante y se asocia con la hiperexpresión de un gen, VviTFL1A, que determina el crecimiento y ramificación de inflorescencias en plantas. La secuenciación de VviTFL1A en cepas de mazuelo y en la variante RRM permitió identificar una nueva inserción de un elemento transponible en la proximidad del gen que provocaría su hiperexpresión.9 De hecho, la reversión del fenotipo RRM se asocia con la escisión y pérdida del elemento transponible. Variantes fenotípicas similares se han observado también en otras variedades de vid como trebbiano toscano y garnacha tinta (fig. 2) y podrían estar asociadas a la hiperexpresión del mismo gen.

A) Racimo de la variante RRM en carignan noir que muestra heterogeneidad en el desarrollo de las bayas. B) Racimo de carignan noir en un estado homogéneo de preenvero. C) Cepa de garnacha tinta que muestra dos pulgares con variación en el desarrollo de las inflorescencias sobre el mismo brazo. D) Inflorescencia normal en el pulgar izquierdo. E) Inflorescencia variante en el pulgar derecho [Fotos A y B realizadas por Lucie Fernández. Fotos C, D y E realizadas por Guillermo Martínez.]
Un caso similar de inserción de un elemento transponible fue detectado también en el origen de la variante FLB (FleshLess Berry) de la variedad trebbiano toscano (ugni blanc). Las plantas FLB producen uvas con semillas y hollejo pero con escaso desarrollo de la pulpa. Este fenotipo también es dominante y se asocia a la expresión en el fruto de un gen, VviPI, que en plantas es necesario para el desarrollo de los pétalos y estambres de la flor. La secuenciación de este gen en cepas de ugni blanc y en la variante FLB permitió identificar también una nueva inserción de un elemento transponible en su proximidad como causante de su expresión en el fruto. Asimismo, en la variante FLB se observa a veces la reversión del fenotipo que siempre se asocia con la escisión del elemento transponible.10
Variación estructural
Quizás los casos de variación somática más conspicuos caracterizados en la vid son los que afectan al color de la uva y generan un gran número de variantes de interés. El color de la uva en Vitis vinifera se debe a la acumulación de pigmentos antocianos en el hollejo, que está formado por la epidermis (que procede de la capa celular L1) y tejido subepidérmico (procedente de la capa celular L2). La síntesis de antocianos en el hollejo está regulada por dos genes que codifican proteínas reguladoras de la familia MYB, que se localizan en una zona del cromosoma 2.11 En la vid hay una enorme diversidad para el color de la uva entre distintas variedades. Las variedades blancas no poseen ninguna copia funcional de estos dos genes MYB, mientras que entre las variedades tintas algunas presentan una copia funcional de cada uno de los dos genes (heterocigotas) y otras dos copias funcionales de cada gen (homocigotas).
Además, es común encontrar variación somática en algunas variedades que siendo originalmente blancas generan variantes rojas o tintas, así como variedades tintas que generan variantes grises o rojas y variantes blancas. Aquí comentaremos el origen de las variantes grises/rojas y blancas que derivan de variedades tintas como en el caso de pinot gris y pinot blanc, garnacha roja (garnacha gris) y garnacha blanca, carignan blanca (cariñena blanca) o tempranillo gris y tempranillo blanco (fig. 3).

De izquierda a derecha, racimos tintos, racimos grises y racimos blancos en las diferentes variantes de color derivadas de la variedad original
Todas las variedades tintas que generan variantes blancas o grises se caracterizan por poseer solo una copia funcional de los dos genes MYB que regulan el color de la uva. En estas variedades, la pérdida de color se ha asociado a la pérdida por deleción de las copias funcionales de los genes MYB.12 El tamaño de estas deleciones es diferente en cada caso y se desconoce la causa y el mecanismo que las provoca. El paso de uva tinta a blanca requiere dos etapas (fig. 4). En una primera etapa se produce la deleción, frecuentemente en una célula de la capa meristemática L2 que suele generar pámpanos que producen uvas rojas o grises en las que las células epidérmicas de la piel de la baya (procedentes de la L1) conservan la capacidad de pigmentación. Esta es una situación de quimerismo periclinal estable que se da en las variedades grises. Cuando las células portadoras de la deleción colonizan también la capa celular L1 del meristemo apical, el sarmiento resultante poseerá la deleción en todas sus células y producirá uvas blancas11 (fig. 4).
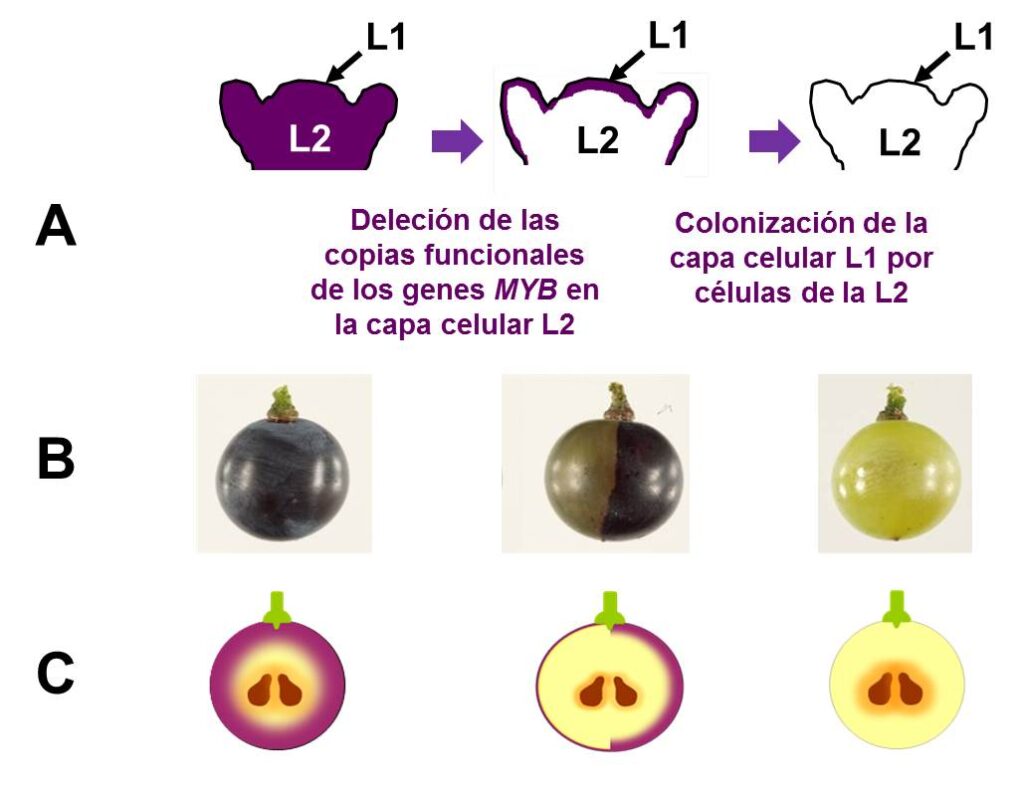
A) De izquierda a derecha evolución de la variación en el ápice del sarmiento. Inicialmente, las dos capas celulares L1 y L2 contienen genes funcionales para el color. En el centro, se representa un ápice en el que se han perdido los genes de color en una célula inicial de la L2 y todas las células descendientes generan una L2 sin genes de color. A la derecha se representa un ápice en el que una célula mutante de la L2 ha colonizado la L1 y sus descendientes generan un ápice en el que tanto L1 como L2 carecen de los genes de color. B) Fotografías de uvas desarrolladas a partir de meristemos con distintos tipos celulares. A la izquierda una uva tinta normal; en el centro una uva quimérica con una mitad gris y otra mitad tinta; a la derecha una uva blanca. C) Esquema de las capas celulares de las uvas con o sin color
En el caso de la variedad tempranillo blanco, la pérdida de color también se produce como consecuencia de la deleción de las copias funcionales de los dos genes MYB.12 Sin embargo, cuando se compara la secuencia del genoma de tempranillo blanco con la del genoma de tempranillo tinto se detectan reorganizaciones del genoma mucho más complejas, no descritas hasta el momento en plantas, que podrían tener efectos adicionales en el fenotipo de esta variedad, más allá de la pérdida de color de la uva.13
Conclusiones
El estudio genético y morfológico combinado con las nuevas tecnologías de secuenciación masiva permite delinear unas primeras conclusiones sobre las características de la variación somática que observamos en la vid y sus posibles causas moleculares. Todas las mutaciones caracterizadas pertenecen a uno de los tres tipos descritos (mutaciones puntuales, inserciones de elementos transponibles y variantes estructurales). Todas afectan a una de las copia del gen alterado (heterocigosis) y producen fenotipos dominantes (con excepción de las deleciones descritas que provocan un fenotipo al alterar la única copia funcional del gen). Estas conclusiones corresponden exactamente con las características esperadas para mutaciones somáticas que generen un cambio fenotípico en un organismo diploide.
Generalmente se considera que las mutaciones dominantes provocan una ganancia de función en el gen afectado. De hecho si repasamos los casos descritos, podemos identificar la generación de proteínas con nuevas características (insensibilidad a giberelinas o mayor actividad catalítica en la síntesis de terpenos) en el caso de las mutaciones puntuales o genes con nuevos comportamientos de expresión (inserciones de elementos transponibles).
Esto permite pensar que, si contamos con objetivos claros de mejora y sistemas adecuados de selección, podremos seguir adaptando las variedades más importantes a las nuevas condiciones de cultivo y desarrollar variedades con nuevas características.
En la vid todavía está por explorar el uso de estrategias de mutagénesis de yemas para aumentar la frecuencia de mutación como se hace en otros frutales y provocar mutaciones de pérdida de función en caracteres que se desee eliminar, como la presencia de semillas o el color de la uva. Por último, es importante destacar que la detección de las causas moleculares de la variación permite la identificación de las nuevas variantes para su seguimiento y protección.
Nota
Los nombres varietales utilizados a lo largo del artículo corresponden a los nombres principales asignados a las variedades por el Vitis International Variety Catalog (www.vivc.de).
Bibliografía
1. Torregrosa L, Fernández L, Bouquet A, Boursiquot JM, Pelsy F, Martínez-Zapater JM: Origins and Consequences of Somatic Variation in Grapevine. En: Adam-Blondon A-F, Martinez-Zapater J-M, Kole C (eds.). Genetics, Genomics, and Breeding of Grapes. Genetics, Genomics and Breeding of Crop Plants. 1st ed. Jersey, British Isles: Science Publishers, 2011, pp 68-92.
2. Ibáñez J, Carreño J, Yuste T, Martínez-Zapater JM: Grapevine breeding and clonal selection programmes in Spain. En: Reynolds A (ed.), Grapevine Breeding Programs for the Wine Industry. Oxford: Woodhead Publishing, 2015, pp. 183-209.
3. This P, Lacombe T, Thomas MR: Historical origins and genetic diversity of wine grapes. Trends Genet 2006; 22 (9): 511-9. doi:10.1016/j.tig.2006.07.008.
5. Boss PK, Thomas MR: Association of dwarfism and floral induction with a grape ‘green revolution’ mutation. Nature 2002; 416 (6883): 847-50. doi:10.1038/416847a.
4. Jaillon O et al. French-Italian Public Consortium for Grapevine Genome C: The grapevine genome sequence suggests ancestral hexaploidization in major angiosperm phyla. Nature 2007; 449 (7161): 463-7. doi:10.1038/nature06148.
6. Duchêne E, Butterlin G, Claudel P, Dumas V, Jaegli N, Merdinoglu D: A grapevine (Vitis vinifera L.) deoxy-D-xylulose synthase gene colocates with a major quantitative trait loci for terpenol content. Theoretical and Applied Genetics 2009; 118: 541. doi:10.1007/s00122-008-0919-8.
7. Emanuelli F, Battilana J, Costantini L, Le Cunff L, Boursiquot JM, This P, Grando MS: A candidate gene association study on muscat flavor in grapevine (Vitis vinifera L.). BMC Plant Biol 2010; 10: 241. doi:10.1186/1471-2229-10-241.
8. Battilana J, Emanuelli F, Gambino G, Gribaudo I, Gasperi F, Boss PK, Grando MS: Functional effect of grapevine 1-deoxy-D-xylulose 5-phosphate synthase substitution K284N on Muscat flavour formation. J Exp Bot 2011; 62 (15): 5497-508. doi:10.1093/jxb/err231.
9. Fernández L, Torregrosa L, Segura V, Bouquet A, Martínez-Zapater JM: Transposon-induced gene activation as a mechanism generating cluster shape somatic variation in grapevine. Plant J 2010; 61 (4): 545-57. doi:10.1111/j.1365-313X.2009.04090.x.
10. Fernández L, Chaib J, Martínez-Zapater JM, Thomas MR, Torregrosa L: Mis-expression of a PISTILLATA-like MADS box gene prevents fruit development in grapevine. Plant J 2013; 73 (6): 918-28. doi:10.1111/tpj.12083.
11. Walker AR, Lee E, Bogs J, McDavid DA, Thomas MR, Robinson SP: White grapes arose through the mutation of two similar and adjacent regulatory genes. Plant J 2007; 49 (5):772-85. doi:10.1111/j.1365-313X.2006.02997.x.
12. Migliaro D, Crespan M, Muñoz-Organero G, Velasco R, Moser C, Vezzulli S: Structural dynamics at the berry colour locus inVitis vinifera L. somatic variants. Aust J Grape Wine R 2014; 20 (3): 485-95. doi:10.1111/ajgw.12103.
13. Carbonell-Bejerano P, Royo C, Torres-Pérez R, Grimplet J, Fernández L, Franco-Zorrilla JM, Lijavetzky D, Baroja E, Martínez J, García-Escudero E, Ibáñez J, Martínez-Zapater JM: Chromothripsis-like genome rearrangements generate somatic loss of berry color in grapevine (en prensa), 2017.