Siempre ha existido un gran temor a la exposición del vino al oxígeno. El contacto excesivo del vino con el oxígeno implica consecuencias negativas en los vinos, produciéndose un deterioro de los compuestos polifenólicos, principalmente de los antocianos, además de una excesiva polimerización y posterior precipitación de materia colorante, reduciéndose el color y cuerpo del vino tinto. Además, a estos fenómenos hay que añadir la pérdida de notas afrutadas, la aparición de altas cantidades de aldehídos desarrollos microbianos indeseables, que comprometen así la calidad del vino.1,2
Pero también se había observado que el contacto del vino con pequeñas cantidades de oxígeno (como ocurre durante la crianza en barrica) tenía consecuencias deseables en la calidad del vino y esto llevó al desarrollo de dispositivos modernos que permiten adicionar, de forma muy controlada y exacta, oxígeno al vino. Por tanto, cuando se habla de microoxigenación (MOX) nos estaremos refiriendo a una técnica que consiste en la aplicación deliberada de pequeñas cantidades de oxígeno de forma continua y controlada, mediante un equipo especial que regula la dosis de oxígeno administrada.3,6
oxígeno (como ocurre durante la crianza en barrica) tenía consecuencias deseables en la calidad del vino y esto llevó al desarrollo de dispositivos modernos que permiten adicionar, de forma muy controlada y exacta, oxígeno al vino. Por tanto, cuando se habla de microoxigenación (MOX) nos estaremos refiriendo a una técnica que consiste en la aplicación deliberada de pequeñas cantidades de oxígeno de forma continua y controlada, mediante un equipo especial que regula la dosis de oxígeno administrada.3,6
Efectos de la microoxigenación
Desde que surgió esta técnica, en la década de los años noventa, numerosos estudios han puesto de manifiesto algunos de los beneficios de su aplicación, como son los siguientes:
Incide sobre las levaduras durante la fermentación alcohólica
El estrés oxidativo es considerado una causa fundamental en la mortalidad temprana de las levaduras en la fermentación. Una correcta adición de oxígeno puede conferirles una mayor tolerancia al etanol y mayor actividad fermentativa, pudiendo de esta forma, decrecer la cantidad de compuestos azufrados que se forman y conseguir también un final más rápido de la fermentación.2
En general, las levaduras necesitan 8-10 mg/L de oxígeno durante la fase inicial de crecimiento para que este sea óptimo. Al principio de la vinificación, el mosto está saturado de oxígeno y no son necesarias adiciones. Pero, al final de la fase de crecimiento, las levaduras todavía necesitan oxígeno y este es el momento correcto para su adición. Si se añade antes, las levaduras solo lo utilizarán en la multiplicación y no en la formación de compuestos de interés,7 y cuando se alcanza aproximadamente un contenido de alcohol del 10%, tampoco se debe adicionar oxígeno, pues las levaduras ya no toman nutrientes ni oxígeno y el oxígeno podría impactar directamente sobre el vino.8
«Al llegar a un contenido de alcohol del 10%, no se debe adicionar oxígeno, pues las levaduras ya no toman nutrientes ni oxígeno y este podría impactar directamente sobre el vino.»
Además, realizando una correcta combinación de oxígeno y sales de amonio, se pueden reducir problemas de paradas de fermentación.2 Las levaduras asimilan más nitrógeno cuando hay oxígeno en el medio, en ausencia de este, los ácidos grasos de cadena corta se acumulan y se pueden secretar al vino, contribuyendo a problemas de parada de fermentación.9
Mejora las características cromáticas y la estabilidad del color de los vinos
Los compuestos fenólicos son uno de los constituyentes más importantes del vino en términos de su alta concentración y por el papel que desempeñan en las propiedades organolépticas del vino.10-13 Entre los compuestos fenólicos, los antocianos y los taninos son de especial importancia, ya que son los principales responsables del color, estructura y boca de los vinos.
Los antocianos son compuestos muy inestables y participan en diferentes reacciones durante la fermentación y la maduración de los vinos para formar pigmentos más complejos. Se han propuestos diferentes mecanismos:
a) Reacciones directas entre antocianos y flavanoles.14,15
b) Reacciones entre antocianos y flavanoles, mediadas por acetaldehído, resultando un nuevo pigmento que posee un puente de etilo y que puede ser desprotonado para dar lugar a un compuesto coloreado.16,17
c) Formación de piranoantocianos a través de la reacción entre antocianos y otros compuestos como el ácido pirúvico, acetaldehído, vinilfenoles y vinilflavanoles.14,18
El resultado de todas estas reacciones es la formación de compuestos estables que estabilizan el color del vino, ya que parcialmente resisten la decoloración por sulfuroso y son más estables al pH del vino. Su formación, importancia relativa y la estructura final de los nuevos pigmentos no solo dependen de la composición fenólica inicial del vino sino también de la presencia de determinados metabolitos de las levaduras y de la exposición al oxígeno, por lo que su formación se ve favorecida por la MOX. Así, la formación de acetaldehído necesario para la formación de aductos coloreados mediados por puentes de etilo y formados por la reacción entre antocianos y flavanoles necesita oxígeno así como la formación de piranoantocianos. La ruta de cicloadición del antociano con moléculas como el ácido pirúvico requiere un paso de oxidación para recuperar la estructura flavilio antes de llegar al producto final.
Mejora las sensaciones en boca de los vinos: cuerpo y astringencia
Hay diferentes sustancias fenólicas implicadas en el amargor, astringencia y complejidad del vino tinto, pero son principalmente los flavanoles los compuestos mayormente responsables. Son moléculas muy reactivas. Las de bajo peso molecular son fundamentalmente amargas, mientras que los polímeros de alto peso molecular son básicamente astringentes y solo ligeramente amargos,19 ya que la astringencia parece estar muy ligada a la longitud del tanino.20 Los taninos sufren reacciones de despolimerización y repolimerización durante el envejecimiento, debido al medio ácido del vino. Estas transformaciones pueden ocurrir en ausencia o presencia de oxígeno, pero diversos estudios parecen demostrar que las estructuras resultantes serán diferentes19 y los formados en presencia de oxígeno no son tan reactivos frente a las proteínas como las uniones directas C4-C8 y C4-C6; serán, por tanto, menos astringentes.21 Así, Parpinello et al.22 demostraron que la MOX mejoró las características sensoriales de un vino de cabernet sauvignon, fundamentalmente su intensidad olfativa, complejidad, astringencia y cuerpo.
Mejora el aroma de los vinos: reducción de carácter vegetal
También se ha comentado que la MOX mejora el aroma del vino, al incrementar las notas afrutadas y disminuir las notas vegetales. Este descenso no parece estar relacionado con los típicos compuestos herbáceos (en particular, los llamados compuestos C6). La reducción de otros compuestos como pirazinas y tioles, que resultan oxidados por el oxígeno, podría contribuir a la reducción del carácter herbáceo de los vinos.
La microoxigenación también puede ayudar en otro problema serio que puede aparecer en los vinos, los conocidos como olores de reducción, atribuidos a compuestos azufrados.23 El oxígeno puede desempeñar un papel importante en el control del problema, ya que durante la fermentación puede ayudar a limitar el impacto de los compuestos azufrados, asegurando la salud de las levaduras y subiendo el potencial redox del vino. Así, compuestos con un umbral de detección muy bajo, como los tioles, serán oxidados a compuestos menos detectables como los disulfitos.
Simula el envejecimiento en barrica
Otro de los objetivos que se busca frecuentemente con el uso de la MOX es el simular, en un depósito, la lenta absorción de oxígeno que ocurre en las barricas y que resulta en una mejora de las características organolépticas de los vinos, con un color más estable y con mayor complejidad en boca.24 Los cambios de color y boca se deben a la microoxigenación natural que se produce en las barricas. Nevares y Del Álamo25 indicaron que el ritmo natural de permeación de oxígeno en barricas de roble francés esta entre 1,66 ml/litro/mes y 2,5 ml/litro/mes y menor en barricas de roble americano.
Pero hay que considerar que las barricas son caras y ocupan mucho espacio en la bodega y tienen una vida limitada. La edad de la barrica afecta mucho al ritmo de difusión del oxígeno, limitándolo ya que los poros de la madera serán taponados por depósitos de vino. Por ello, la microoxigenación se puede ver como una técnica alternativa para simplificar la crianza.
«Los cambios de color y boca se deben a la microoxigenación natural que se produce en las barricas.»
Cano-López et al.26,27 estudiaron la evolución de las características cromáticas de un vino durante tres meses en tres situaciones diferentes: depósito de acero con aplicación de MOX, envejecimiento en barrica nueva o envejecimiento en barrica usada. Los resultados indicaron que la MOX mejoró el color del vino microoxigenado de forma similar a la barrica nueva y a los tres meses ambos vinos eran muy similares cromáticamente. Pero no evolucionaron igual durante el almacenamiento en botella, observándose una degradación del color algo mayor en el vino MOX. Probablemente los compuestos fenólicos extraídos de la madera durante el envejecimiento (elagitaninos, ácidos fenólicos y aldehídos de la madera) también tengan un papel importante en la protección del color de los vinos durante el envejecimiento.
Asimismo es importante no olvidar la mejora de aroma que supone el envejecimiento en barrica por extracción de compuestos aromáticos de la madera. Esto se intenta completar, en los vinos microoxigenados, con la adición de chips de madera. Los estudios de McCord28 mostraron que cuando la adición de chips de madera se realiza simultáneamente con MOX se extraen más compuestos de la madera. Parece ser que la oxigenación del vino facilita la extracción de compuestos de la madera y el vino resultante es el preferido por los consumidores.29 Así, Oberholster et al.30 publicaron que la MOX, en combinación con chips de madera, daba resultados similares sensorialmente a vinos envejecidos en madera durante breves períodos (6 meses).
| Equipo de microoxigenación
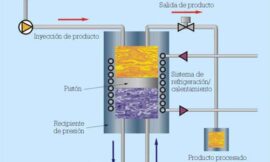
Ya se ha indicado que el sistema consiste en una fuente de oxígeno, un controlador para la dosificación de este oxígeno y un microdifusor poroso. Una de las partes más importantes del equipo de MOX es la dosificación del oxígeno. El difusor es un cilindro cerámico perforado que convierte el flujo de oxígeno en finas burbujas, las cuales se dispersan rápidamente en el vino. El llenado de la cámara de dosificación y su expansión se realizada mediante dos electroválvulas controladas por medio de un programador.3,4 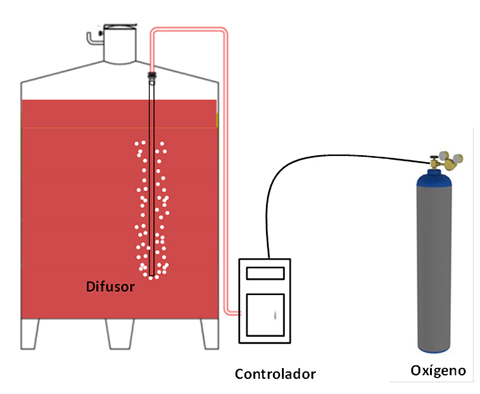
La adición de oxígeno en forma de microburbujas se incremente la superficie de contacto entre el gas y el vino, y por tanto una buena disolución del oxígeno en él.31 
Se considera normalmente que las dimensiones mínimas del depósito deben ser de 2,5 metros de altura y la posición del difusor en él, a unos 10 o 20 cm del fondo, evitando así el contacto con las lías ya que estas absorben oxígeno; de esta forma, las microburbujas se disuelven en el vino durante el recorrido antes de llegar a la superficie.6 |
Factores que influyen en la dosis de oxígeno aplicada
La concentración de SO2
El SO2 no reacciona directamente con el oxígeno, pero si que actúa como antioxidante, reaccionando con los productos intermedios que se forman durante la ruta de reducción del oxígeno, lo que afecta fundamentalmente a la producción de acetaldehído, y/o ligándose de forma irreversible al acetaldehído que se forme, lo que evita que el acetaldehído generado en la MOX participe en reacciones de condensación y polimerización. Además, el SO2 tiene la capacidad de reducir los polifenoles oxidados y regenerar sus formas iniciales, parando de esta forma la polimerización regenerativa. Los efectos de la MOX en presencia de altas cantidades de SO2 se logran con mayor dificultad y tardan más tiempo en producirse.5
El momento de la aplicación de la microoxigenación
La MOX puede ser aplicada en cualquier momento de la elaboración y maduración del vino (fig. 3).
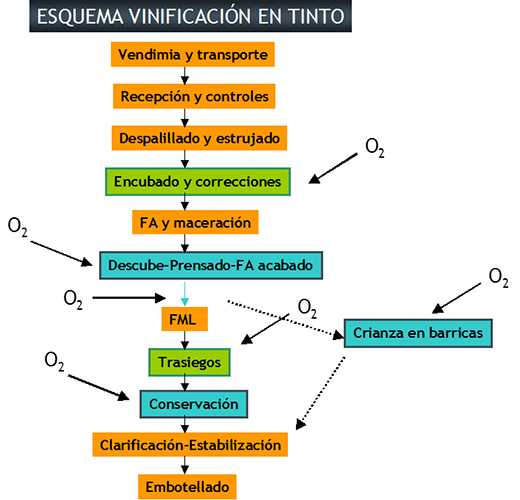
Si nos centramos en la principal aplicación de la microoxigenación, es decir, la estabilización del color del vino, se ha observado que la aplicación de la MOX entre el final de fermentación alcohólica e inicio de la fermentación maloláctica da lugar a los resultados más efectivos, ya que la aplicación de oxígeno permite obtener vinos con una intensidad colorante más elevada. Este mayor efecto está justificado por dos razones; por una parte, debido a que al finalizar la fermentación alcohólica el contenido de SO2 libre es prácticamente cero y, por otra parte, en este momento el contenido de antocianos monoméricos es mayor y, por tanto, la MOX estabiliza a estos antocianos y limita la polimerización de taninos.
Al finalizar la fermentación maloláctica, la aplicación de la MOX asegura una cantidad de acetaldehído suficiente para el desarrollo de nuevos pigmentos, pero las dosis a aplicar deben ser menores, ya que el vino tiene menor contenido de antocianos libres, y se podría ver favorecida la polimerización de taninos produciendo vinos más secos o incluso provocar la sobreoxidación del vino. Además, el efecto del SO2 sobre las reacciones de oxidación de los polifenoles es mayor debido a su mayor contenido tras la fermentación maloláctica.
La composición fenólica inicial del vino
Por regla general, la facilidad de consumir oxígeno por parte del vino y, en consecuencia, su tolerancia al oxígeno es directamente proporcional a la concentración de polifenoles, siendo estos los responsables del 60% del consumo de oxígeno, sin olvidar el etanol que representa un 20% y el SO2 con un 12%.31,32
Los efectos de la MOX en un vino con concentraciones desequilibradas de antocianos y taninos producirá una polimerización excesiva de flavanoles y sequedad en el vino, con su posterior precipitación en el caso de un exceso de flavan-3-oles o una oxidación de los antocianos que producirá pérdidas de color si el vino tiene un exceso de antocianos. Por ello es necesario que exista un equilibrio entre antocianos y taninos, de tal manera que el acetaldehído producido intervenga en las reacciones de condensación entre taninos y/o entre antocianos y taninos aumentando el color y cuerpo del vino, además de disminuir la astringencia.
 Cano-López et al.33 estudiaron cómo la microoxigenación afectaba cromáticamente a tres vinos de la variedad monastrell que diferían en su contenido fenólico. Todos los vinos estudiados mejoraron sus características cromáticas, favoreciéndose la formación de nuevos pigmentos, aunque lo fue más en los vinos con el contenido fenólico más alto, lo que se tradujo en un incremento mayor de la intensidad de color. El vino de menor contenido fenólico resultó el menos favorecido por la MOX y el estudio de la estructura de sus taninos indicó una posible sobreoxigenación de los vinos.
Cano-López et al.33 estudiaron cómo la microoxigenación afectaba cromáticamente a tres vinos de la variedad monastrell que diferían en su contenido fenólico. Todos los vinos estudiados mejoraron sus características cromáticas, favoreciéndose la formación de nuevos pigmentos, aunque lo fue más en los vinos con el contenido fenólico más alto, lo que se tradujo en un incremento mayor de la intensidad de color. El vino de menor contenido fenólico resultó el menos favorecido por la MOX y el estudio de la estructura de sus taninos indicó una posible sobreoxigenación de los vinos.
La cantidad de oxígeno aplicada
La dosis de oxígeno aportado dependerá del objetivo a alcanzar por el tratamiento. Por ejemplo, la eliminación de aromas de reducción requiere aportes más bajos que para conseguir modificaciones en el color y estructura del vino.
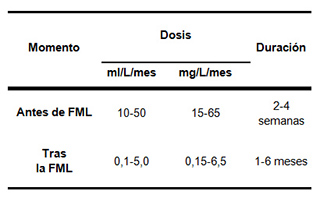
También, la dosis aplicada dependerá del estado de maduración de la uva, la composición fenólica del vino y del momento de la aplicación, como se muestra en la tabla.5,7
También depende de la variedad de uva utilizada para elaborar el vino. Así se ha observado que el impacto de la microoxigenación en un vino de merlot es mayor que en los vinos de cabernet sauvignon, posiblemente debido a la composición inicial de los vinos, siendo mayor el incremento de color en los vinos de merlot (35%) que de cabernet sauvignon (7%) tras la crianza en barrica.
La temperatura
A la hora de microoxigenar un vino es importante tener en cuenta la temperatura a la que estamos trabajando. A bajas temperaturas, la solubilidad del oxígeno en el vino es mayor, y las reacciones en las que interviene son más lentas, reduciéndose así su consumo; por ello, es posible que se dé una acumulación de oxígeno en el vino. En resumen, a bajas temperaturas se disminuye la dosis aplicada evitando su acumulación en el vino.
Al contrario, a temperaturas elevadas (>22ºC) todas las reacciones químicas se aceleran, se incrementa la velocidad de formación de quinonas (productos de la oxidación de compuestos fenólicos), se consume todo el oxígeno y hay menos selectividad entre las reacciones.
La turbidez
La turbidez se debe a la presencia de coloides y lías en suspensión que, con el tiempo, van precipitando. Las lías situadas en el fondo del depósito consumen oxígeno. Para evitar consumos no controlados de oxígeno se deberá microoxigenar con una turbidez menor a 100 UTN. Además, la presencia de turbios dificulta una oxigenación homogénea.
Parámetros del vino a controlar durante la microoxigenación
El control durante la MOX debe ser cuidadoso y constante, ya que la evolución del vino durante la microoxigenación puede complicarse. Así, por ejemplo, una excesiva oxidación de antocianos o una gran polimerización de compuestos fenólicos producirán pérdidas de color y una mayor sensación de sequedad en boca. Además, cada vino evoluciona de diferente forma.
Hay varios parámetros que nos pueden indicar cómo va evolucionando el vino que está siendo microoxigenado. Dependiendo del nivel tecnológico de las bodegas, el control puede ser básico, intermedio o especializado:
Parámetros a nivel básico: Temperatura, SO2 libre y total, control del inicio y final de la fermentación maloláctica, cata de los vinos. El control de la concentración de SO2 libre puede ser efectiva durante la MOX de los vinos, siempre que no sea posible la medida de oxígeno disuelto, ya que un rápido descenso indicaría altos niveles de oxigenación. Por tanto, los descensos de SO2 libre son importantes: una disminución a valores mas bajos de 10 ppm supone que el vino se expone a una importante oxidación.
Parámetros a nivel intermedio: Oxígeno disuelto en el vino, turbidez y acidez volátil.
Parámetros a nivel especializado: Color, composición polifenólica, concentración de acetaldehído, formación de nuevos pigmentos, control de la población de bacterias acéticas y levaduras del género Brettanomyces.
Posibles riesgos durante la microoxigenación
Se debe evitar una acumulación de oxígeno en el vino, ya que puede originar una polimerización excesiva de compuestos polifenólicos y generar una mayor sequedad en boca34 y la precipitación de compuestos fenólicos polimerizados dando lugar a un descenso de color en los vinos.2
Además, los niveles de acetaldehído no deben sobrepasar sus umbrales de detección, especialmente tras la fermentación maloláctica. Por ello, la dosis de oxígeno aplicada tras la fermentación maloláctica debe ser menor que entre el fin de la fermentación alcohólica y el inicio de la fermentación maloláctica, no comprometiendo así a la calidad aromática del vino.
«Dosificaciones no adecuadas pueden provocar pérdida de notas afrutadas (…) y oxidación de aromas.»
En el caso de una dosificación no adecuada puede producirse la pérdida de notas afrutadas junto con la presencia de aromas no deseables debido a la oxidación de aromas. Dichos efectos pueden ocurrir incluso antes de observar la oxidación a nivel visual y por ello la importancia de la cata de los vinos.
Uno de los problemas que pueden aparecer es el incremento de la población de varios microorganismos no deseados en el vino, como las bacterias acéticas, que metabolizan el etanol a ácido acético y pueden causar un incremento significativo de la acidez volátil. Por otro lado, la acción de las levaduras del género Brettanomyces –cuyo desarrollo se favorece en presencia de oxígeno– en la producción de fenoles volátiles (como 4-etilfenoles volátiles) podrían en riesgo la calidad del vino.1,2
Por estos motivos, la aplicación de la MOX del vino requiere experiencia y además un cuidadoso control de los diferentes parámetros anteriormente comentados durante su aplicación.
Conclusión
La tecnología de la microoxigenación o MOX puede proporcionar al enólogo un nuevo método para el desarrollo y mejora de las características organolépticas de sus vinos (aroma, sabor y color) y ser una oportunidad para corregir algunos problemas típicos del vino (olores a reducción, por ejemplo).
Para conseguir estos objetivos con éxito, el proceso debe ser conocido y controlado con exactitud. Antes de aplicar la MOX, el enólogo tiene que tener claras algunas cuestiones básicas, como son las condiciones iniciales de sus vinos, pero también cuál es el uso final que les quiere dar a estos vinos. Con estos detalles en la mente, la MOX podrá ser adaptada para ajustase lo mejor posible a los deseos del enólogo.
Bibliografía
1. Du Toit W.C., Pretorius I.S., Lonvaud-Funel A.: The effect of sulphur dioxide and oxygen on the the viability and culturabylity of a strain of Acetobacter pasteurianus and a strain of Brettanomyces bruxellensis isolated from wine. J App Microbiol 2005; 98: 862-71.
2. Du Toit W., Marais J., Pretorius I.S., du Toit M.: Oxygen in must and wine: A review. S Afr J Enol Vitic 2006; 27: 76-94.
3. Boulet J., Moutounet, M.: Micro-oxigenación de los vinos. En Flanzy C. (ed.): Enología: Fundamentos científicos y tecnológicos. Madrid: AMV Ediciones, 2000, pp. 638-42.
4. Parish M., Wollan D., Paul R.: Micro-oxygenation. A review. The Australian & New Zealand Grapegrower & Winemaker 2000; 438: 47-50.
5. Paul R.: Micro-oxygenation. Where now? En: Australian Society of Oenology and Viticulture (ed.), Use of gases in winemaking. Adelaide, Australia: ASOV, 2002, pp. 18-31.
6. Moutounet M., Mazauric J.P., Ducournau P., Lemaire T.: Micro-oxygénation des vins. Principe at applications technologiques. Industrie delle Bevande 2001; 30: 253-8.
7. Zoecklein B.: Surfur-containing compounds. Enology 2003; notes 70. Disponible en: www.fst.vt.edu/extension/enology/EN/70.html.
8. Comfort S.: An introduction to understanding oxygen and fermentation. The YeastWhisperer. Disponible en www.yeastwhisperer.com.
9. Bardi L., Cocito C., Marzona M.: Saccharomyces cerevisiae cell fatty acid composition and release during fermentation without aeration and in absence of exogenous lipids. Int J Food Microbiol 1999; 47: 133-40.
10. Ribéreau-Gayon P., Glories Y.: Phenolics in grapes and wines. En Lee T. (ed.), Adelaide: Proc 6th Aust Wine Ind Tech Conf Australian Industrial Publishers, 1987, pp. 247-56.
11. Cheynier V., Prieur C., Guyot S., Rigaud J., Moutounet M.: The structures of tannins in grapes and wines and their interaction with proteins. En Watkins T.R. (ed.). Wine; nutritional and therapeutic benefits. Washington, DC: American Chemical Society (ACS Symposium Series 661): 1997, pp 81-93.
12. Kennedy J.A., Saucier C., Glories Y.: Grape and wine phenolics: History and perspective. Am J Enol Vitic 2006; 57: 239-48.
13. Ribéreau-Gayon P., Glories Y., Maujean A., Durboridieu D.: Handbook of Enology.Volume 2. The chemistry of wine, stabilization and treatments. Chichester: John Wiley and Sons, 2006, pp 91-108.
14. Fulcrand H., Cameira dos Santos P., Sarni Manchado P., Cheynier V., Favre Bonvin J.: Structure of new anthocyanin-derived wine pigments. J Chem Soc Perkin Trans 1996; 17: 735-9.
15. Remy S., Fulcrand H., Labarde B., Cheynier V., Moutounet M.: First confirmation in red wine of products resulting from direct anthocyanin-tannin reactions. J Sci Food Agric 2000; 80: 745-51.
16. Atanasova V., Fulcrand H., Cheynier V., Moutounet M.: Effect of oxygenation on polyphenol changes occurring in the course of wine-making. An Chim Acta 2002; 458: 15-27.
17. Saucier C., Little D., Glories Y.: (1997). First evidence of acetaldehyde- flavanol condensation products in red wine. Am J Enol Vitic 1997; 48: 370-2.
18. Fulcrand H., Benabdejalil C., Rigaud J., Cheynier V., Moutounet M.: A new class of wine pigments generated by reaction between pyruvic acid and grape anthocyanins. Phytochemistry 1997; 47: 1401-7.
19. Vidal S., Aagaard O.: Oxygen management during vinification and storage of Shiraz wine. Wine Industry Journal 2008; 23. Disponible en: www.winebiz.com.au.
20. Vidal S., Francis L., Noble A.C., Kwiatkowski M., Cheynier V., Waters E.J.: Taste and mouth-feel properties and different types of tannin-like polyphenolic compounds and anthocyanins in wine. Anal Chim Acta 2004; 513: 57-65.
21. Tanaka T., Takahashi R., Kouno I., Nonaka K.: Chemical evidence for the de-astringency (insolubilization of tannins) of persimmon fruit. J Chem Soc Perkin Trans 1994; 3013-22.
22. Parpinello G., Plumejeau F., Maury C., Versari A.: Effect of micro-oxygenation on sensory characteristics and consumer preference of Cabernet Sauvignon wine. J Sci Food Agric 2011; 92: 1238-44.
23. Jackson R.S.: Wine science. Principles, practice and perception. San Diego, CA: Academic Press, 2000.
24. Pérez-Prieto L.J., De la Hera Orts M.L., López-Roca J.M., Fernández-Fernández J.I., Gómez-Plaza E.: Oak matured wines. Influence of the characteristics of the barrel on wine colour and sensory characteristics. J Sci Food Agric 2003; 83: 1445-50.
25. Nevares I., Del Álamo M.: Measurement of dissolved oxygen during red wines tank aging with chips and micro-oxygenation. Anal Chim Acta 2008; 621: 68-78.
26. Cano-López M., Pardo-Mínguez F., López-Roca J.M., Gómez-Plaza E.: Effect of micro- oxygenation on anthocyanin and derived pigment content and chromatic characteristics of red wines. Am J Enol Vitic 2006; 57: 325-31.
27. Cano-López M., Pardo-Mínguez F., López-Roca J.M., Gómez-Plaza E.: Chromatic characteristics and anthocyanin profile of a micro-oxygenated red wine after oak or bottle maturation. Eur Food Res Tech 2007; 225: 125-32.
28. McCord J.: Application of toasted oak and micro-oxygenation to aging of Cabernet sauvignon wines. The Australian & New Zealand Grapegrower & Winemaker 2003; 474: 43-53.
29. Bautista Ortín A.B., Iniesta Ortiz J.A., Pardo Mínguez F., López Roca J.M., Gómez Plaza E.: Establización del color de los vinos tintos utilizando la micro-oxigenación conjuntamente con taninos enológicos o virutas de roble. Una alternativa a la crianza en barricas. Enólogos 2008; 52: 38-41.
30. Oberholster A., Elmendorf B., Lerno L., King E., Heymann H., Brenneman C., Boulton R.: Barrel maturation, oak alternatives and micro-oxygenation: Influence on red wine aging and quality. Food Chemistry 2015; 173: 1250-8.
31. Devatine A., Chiciuc I., Poupot C., Mietton-Peuchot M.: Micro-oxygenation of wine in presence of dissolved carbon dioxide. Chem Engin Sci 2007; 62: 4579-88.
32. Singleton V.: Oxygen with phenols and related reactions in must, wines and model systems:observations and practical implications. Am J Enol Vitic 1987; 38: 69-77.
33. Cano-López M., Pardo-Mínguez F., Schmauch G., Saucier C., Teissedre P., López-Roca J.M., Gómez-Plaza E.: Effect of micro-oxygenation on color and anthocyanin-related compounds of wines with different phenolic contents. J Agric Food Chem 2006; 56: 5932-41.
34. Nikfardjam M., Dykes S.I.: Micro-oxygenation research at Lincoln University. Part 3: Polyphenolic analysis of Cabernet Sauvignon wines under the application of micro-oxygenation. The Australian & New Zealand Grapegrower & Winemaker 2003; 467: 41-4.