Introducción
 Los compuestos fenólicos contribuyen a características sensoriales como el color, el sabor y la astringencia del vino, bien directamente o por interacción con proteínas, polisacáridos u otros compuestos fenólicos.[1] Además, determinan la evolución de estas propiedades del vino y, por tanto, son los responsables de su estabilidad sensorial, y en consecuencia de su longevidad. En las uvas, pueden distinguirse compuestos fenólicos flavonoides: antocianos, flavonoles, flavanoles (catequinas, procianidinas y taninos), y compuestos fenólicos no flavonoides: ácidos hidroxibenzoicos e hidroxicinámicos y sus ésteres, estilbenos y fenoles volátiles.[1] La cantidad de estos compuestos depende en gran medida de la variedad,[1] de los factores ambientales,[2] de las técnicas agronómicas,[3] del terroir [4] y de la interacción variedad-terroir.[5]
Los compuestos fenólicos contribuyen a características sensoriales como el color, el sabor y la astringencia del vino, bien directamente o por interacción con proteínas, polisacáridos u otros compuestos fenólicos.[1] Además, determinan la evolución de estas propiedades del vino y, por tanto, son los responsables de su estabilidad sensorial, y en consecuencia de su longevidad. En las uvas, pueden distinguirse compuestos fenólicos flavonoides: antocianos, flavonoles, flavanoles (catequinas, procianidinas y taninos), y compuestos fenólicos no flavonoides: ácidos hidroxibenzoicos e hidroxicinámicos y sus ésteres, estilbenos y fenoles volátiles.[1] La cantidad de estos compuestos depende en gran medida de la variedad,[1] de los factores ambientales,[2] de las técnicas agronómicas,[3] del terroir [4] y de la interacción variedad-terroir.[5]
En el caso de los vinos tintos, la cantidad y distribución de polifenoles juega un papel fundamental, pues determina su aptitud para ser sometido o no a crianza. En este tipo de vinos, el color está relacionado con la acumulación de antocianos en la piel de las bayas y con los fenómenos de copigmentación que ocurren desde los primeros momentos de la elaboración del vino y pueden representar entre el 30-50 % del color en los vinos jóvenes.[6] La copigmentación en el vino es el resultado de interacciones moleculares entre las antocianinas y otras moléculas orgánicas, denominadas cofactores, que forman asociaciones moleculares o complejos. Entre los cofactores más comunes se encuentran los ácidos fenólicos y los flavonoides. Darías-Martín et al.[7] concluyeron que el color del vino tinto está generalmente limitado por los niveles de cofactores disponibles para la copigmentación más que por el nivel de antocianinas por sí solas. Posteriormente, durante la crianza son importantes para el color y la estabilidad del mismo y la astringencia los compuestos antocianos-taninos. Esto demuestra la importancia de la composición no pigmentada en el establecimiento del color del vino tinto, la influencia de la composición inicial del mosto y, por esta razón, los compuestos fenólicos se clasifican a menudo en compuestos antociánicos y no antociánicos.
Las variedades minoritarias, por lo general son variedades autóctonas escasamente difundidas, generalmente ligadas y únicas de un determinado territorio y, por tanto, bien adaptadas localmente por lo que su empleo puede ser una herramienta útil para promover la diversificación de los productos vitivinícolas.[1] La recuperación, caracterización y selección de variedades minoritarias es actualmente una tarea primordial para viticultores y enólogos, pues supone un aumento del patrimonio varietal y un aumento de la diversidad de los vinos comercializados. Este trabajo resume los principales hallazgos en cuanto a composición fenólica de las uvas procedentes de variedades minoritarias investigadas en el proyecto MINORVIN. Esta información ayudará a planificar las prácticas enológicas y conseguir productos que se diferencien del resto y así se conseguirá un mayor interés en su recuperación potencial.
Materiales y métodos
En todas las variedades y zonas, y en las dos vendimias en estudio, las uvas se vendimiaron con un grado de alcohol probable (GAP) entre 12-14 (% v/v). Las muestras se congelaron y enviaron al INTAEX donde se mantuvieron congeladas hasta su procesado. En la cosecha 2019 se analizaron muestras procedentes de 23 variedades tintas oriundas de 8 zonas vitícolas. En el 2020 el número de variedades tintas analizadas fueron 28 y procedían de 9 zonas vitícolas.
A partir de 50 g de uvas sanas se extrajeron las sustancias polifenólicas con metanol/agua/ácido fórmico (50: 48,5: 1,5, v/v/v) según el método descrito en el apartado [8] de la bibliografía, con ligeras modificaciones.[1, 9] El análisis de sustancias fenólicas se efectuó mediante HPLC (Agilent 1200 LC system) equipado con bomba cuaternaria, y detectores DAD, y fluorescencia. Para el análisis de los antocianos (AN) el extracto se inyectó directamente en el HPLC y el aislamiento de los compuestos no antociánicos se realizó según trabajos previos.[9, 10] Los extractos fenólicos se pasaron a través de cartuchos PCX SPE y las sustancias fenólicas no antociánicas se eluyeron con metanol. El eluido, que contenía flavonoles (Flavo), catequinas (Cat), proantocianidinas (Pro), ácidos fenólicos y sus ésteres (AF) y estilbenos (Est), se concentró en un evaporador rotatorio (40 °C) y se redisolvió en solución acuosa de metanol al 20 % (v/v). Se empleó una columna Licrospher® 100 RP-18, 250 × 4,0 mm; 5 µm packing; Agilent Technologies, Palo Alto, CA, USA). Para la identificación y cuantificación de los compuestos se registraron cromatogramas a 280, 320, 360 y 520 nm en el detector de matriz de diodos (DAD). Para caracterizar los compuestos fenólicos del extracto se utilizaron el orden de elución, el tiempo de retención, los espectros UV/vis y la comparación cruzada con los estándares disponibles y con trabajos anteriores.[1, 8, 9,10] Para la cuantificación, se obtuvieron y analizaron cromatogramas DAD a 520 nm (antocianinas), 360 nm (flavonoles), 320 nm (ácidos fenólicos y estilbenos) y 280 nm (flavanoles). La excitación a 280 y la emisión a 320 nm se midieron mediante fluorescencia (FLD) para la identificación de los siguientes compuestos: (+)-catequina y pro-cianidina B2. Para la cuantificación y calibración de cada compuesto se utilizaron curvas de calibración de sus respectivos estándares (R2 > 0,999). La cuantificación de los compuestos no comerciales se realizó utilizando el compuesto de calibración puro perteneciente a la misma familia al siguiente compuesto en el orden de elución.
Se identificaron un total de 36 sustancias fenólicas: Los antocianos (AN) presentes en los extractos se identificaron y cuantificaron como glucósidos simples no acilados, derivados acetilados y formas derivadas cumariladas de delfinidina, cianidina, petunidina, peonidina y malvidina. La cantidad total de AN se dio en mg de malvidina-3-glucósido/kg peso fresco de baya. Además, se identificaron las catequinas: (+)-catequina, (-)-epicatequina, galocatequina, epigalocatequina y las procianidinas B1, B2 y B3. Se cuantificaron como mg de (+)-catequina/kg peso fresco de baya. Los Flavo identificados fueron los 3-glucósidos de miricetina, kaempherol, quercetina, isorhamnetina, 3-rutinósido de quercetina y kaempherol, quercetina-3-galactósido y quercetina-3-glucurónido y se cuantificaron como mg de quercetina-3-glucósido/kg peso fresco de baya. Los ácidos gálico, cafeico, ferúlico y coutárico se identificaron y cuantificaron como mg de ácido cafeico/kg peso fresco de baya. Por último, el estilbeno identificado y cuantificado fue el t-resveratrol (mg/kg peso fresco de baya). La cantidad total de polifenoles (PT) se calculó como el sumatorio de todos los compuestos analizados.
Se calcularon los porcentajes medios bianuales de cada familia respecto a la de PT obteniendo así los perfiles fenólicos de cada variedad y los resultados se sometieron a un análisis de clúster. Se empleó el paquete estadístico XLSTAT (Addinsoft, París).
Resultados y discusión
La figura 1 muestra los resultados de los datos medios de AN, Cat, Pro y PT y la figura 2 los de Flavo, AF y Est obtenidos en las muestras de las diferentes variedades y zonas en las cosechas 2019 y 2020.
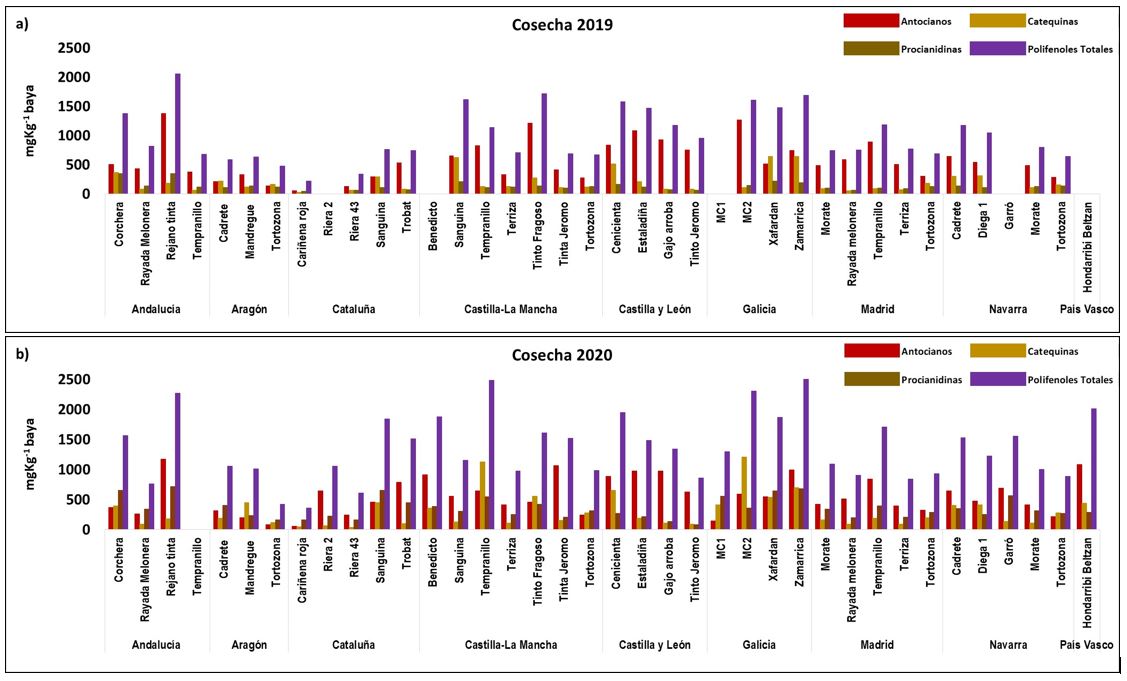
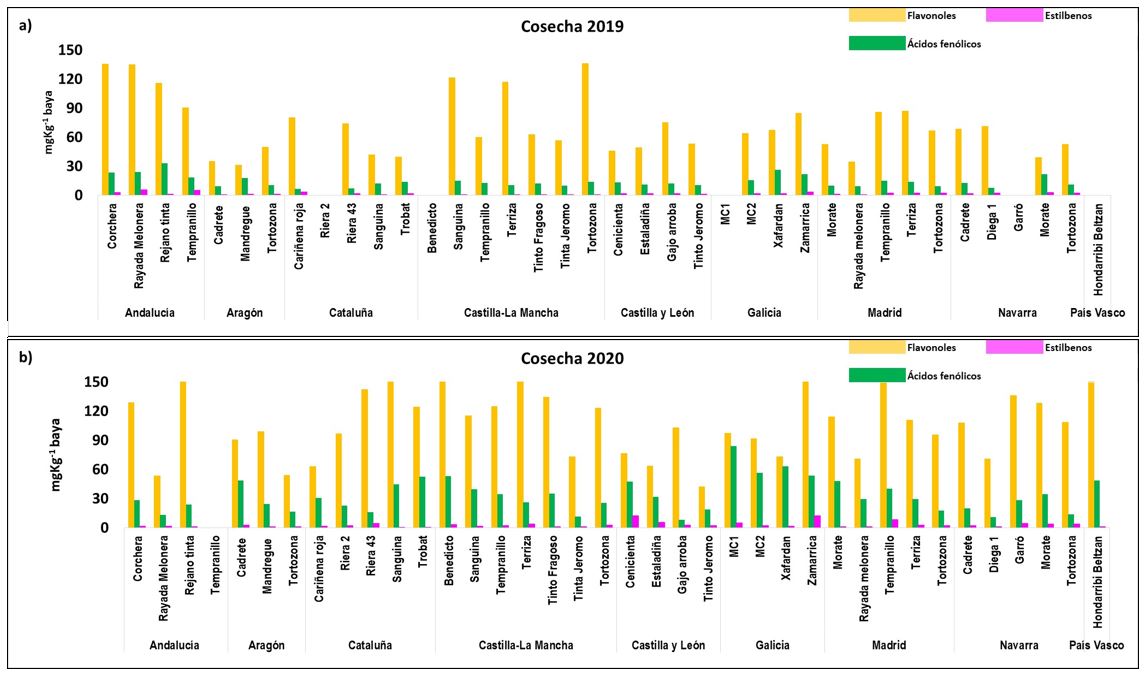
Las gráficas reflejan que las diferentes condiciones medioambientales registradas en las diferentes zonas provocaron un efecto/año en todas las familias fenólicas estudiadas. Como regla general, los valores superiores se hallaron en el 2020, independientemente de la zona y variedad considerada. Estos resultados sugieren que las condiciones metereológicas de ese año (temperaturas suaves y lluvias generalizadas durante el período pre-envero en casi toda la península) contribuyeron a una mejor biosíntesis y acumulación de los compuestos fenólicos de las variedades estudiadas. Puede observarse que, frente a la variedad Tempranillo cultivada en Castilla-La Mancha, en la que los valores de polifenoles totales de 2020 fueron claramente superiores a los del año anterior, los de las variedades Sanguina, Terriza y Tinto Fragoso cultivadas en la misma zona fueron muy similares. Cuando se analizan los valores de las diferentes familias fenólicas, se observa que hay variedades con grandes cantidades de antocianos (AN) como la andaluza Rejano tinta y las castellano-leonesas Cenicienta, Gajo Arroba, Estaladiña y Tinto Jeromo. Sin embargo, las gallegas Xafardan y Zamarrica destacaron por sus altos contenidos en catequinas (Cat) y proantocianidinas (Pro). En el caso de los flavonoles (Flavo) (Figura 1b) por lo general, los valores fueron superiores en las uvas de zonas más cálidas como Andalucía y Castilla-La Mancha.
A fin de disminuir la variabilidad debida al año y obtener una caracterización del perfil fenólico de las variedades en estudio, se calculó para cada muestra el porcentaje de cada familia respecto del valor total de polifenoles (PT). Los valores medios bianuales de los perfiles obtenidos se sometieron a análisis de clúster. El dendograma resultante proporcionó las 6 clases que aparecen en la figura 3.
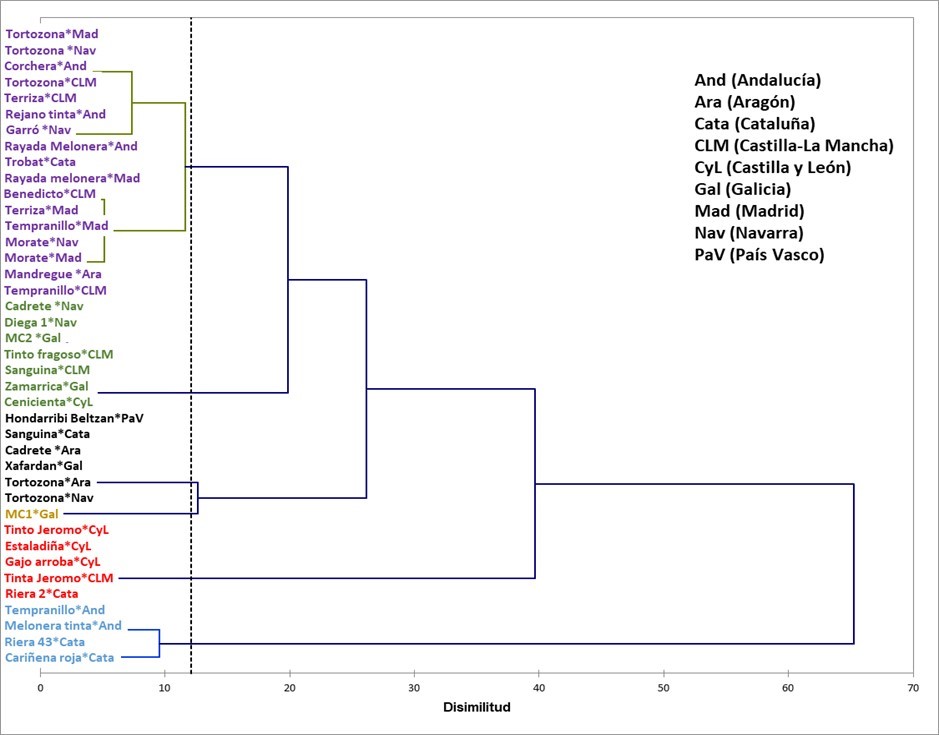
Las muestras clasificadas en función de variedad * y zona englobadas en cada clase resultante del clúster se presentan en la tabla 1.

Claramente se observa que, como ya se ha informado en anteriores ocasiones, el factor varietal determina en gran medida el perfil fenólico[5, 10] pues, por lo general, una determinada variedad procedente de diferentes zonas está englobada en la misma clase resultante del clúster. Así, las dos muestras analizadas de Tinto Jeromo, procedentes de Castilla y León y Castilla-La Mancha se localizaron en la clase 1; en la clase 2 se encuadraron las dos de Rayada Melonera, procedentes de Andalucía y Madrid, las dos de Morate procedentes de Madrid y Navarra y las dos de Terriza cultivadas en Castilla-La Mancha y Madrid. Las muestras Tortozona, se encuadraron en las clases 2 y 5, destacando que una de las dos muestras de Navarra se situó en la misma clase que la procedente de Aragón.
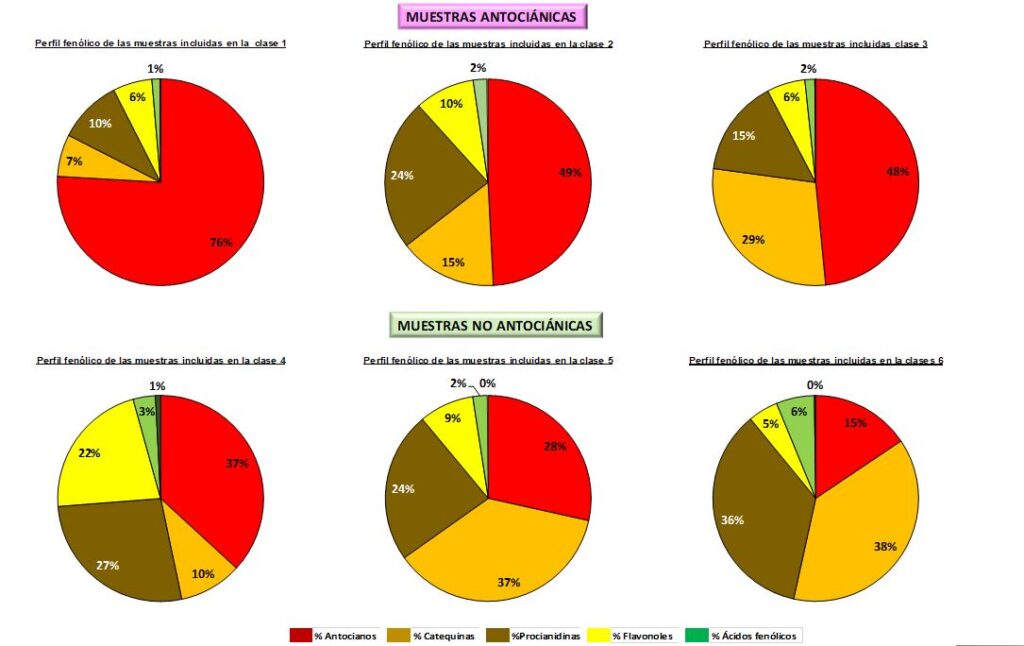
Finalmente, la figura 4 proporciona los perfiles fenólicos típicos de cada clase. De mayor a menor porcentaje de AN, la clase 1 engloba las muestras con el mayor porcentaje de AN (~ 70 %). Se trata de uvas con un alto porcentaje de antocianos que, de ser elaboradas monovarietalmente, podrían ser destinadas a vinos rosados o tintos jóvenes dado su bajo porcentaje de compuestos fenólicos en Cat y Pro con los que asociarse para poder construir moléculas más estables que aseguraran la permanencia del color en el tiempo. Los perfiles fenólicos de las muestras englobadas en los grupos 2 y 3 son similares; en ambos casos contienen similares porcentajes de antocianos y flavanoles como catequinas y proantocianidinas. Estas dos últimas clases de compuestos fenólicos al polimerizarse y transformarse en taninos aportarán astringencia, además pueden asociarse a los antocianos durante la fermentación y posterior crianza y contribuir a estabilizar el color de los vinos; en las de la clase 2 predominan Pro y en las del 3, las Cat. En las clases 4, 5 y 6 se incluyen muestras en cuyo perfil no predominan AN (50 % > % AN). Las de la clase 4 destacaron por presentar los mayores porcentajes de Flavo de todas las muestras; es preciso recordar que estas sustancias tienen una gran capacidad para actuar como copigmentos responsables del color de vinos jóvenes como se ha mencionado anteriormente. MC1 fue la única variedad incluida en la clase 6 y destacó por ser una variedad no antociánica con altos porcentajes de Cat y Pro. Las muestras englobadas en las clases 5 y 6 podrían considerarse para ser empleadas en mezclas con otras variedades más antociánicas, como las englobadas en la clase 1.
Conclusión
Se ha efectuado la evaluación del contenido y distribución del potencial polifenólico de las variedades tintas minoritarias procedentes de diferentes zonas españolas. Los resultados confirman el papel varietal como elemento decisivo en el perfil fenólico de la uva y por tanto la necesidad de su investigación. El conocimiento de los perfiles fenólicos de estas variedades puede proporcionar datos relevantes para la evaluación del potencial enológico de cada variedad y, como resultado, la optimización del proceso enológico y definición del tipo de vino más adecuado que podría elaborarse con cada una de ellas, de forma que se podrá ampliar el espectro de los vinos comercializados.
Agradecimientos
Proyecto Valorización de variedades minoritarias de vid por su potencial para la diversificación vitivinícola y de resiliencia al cambio climático (MINORVIN), RTI2018-101085-R-C31, 32 y 33 financiado por MCIN/AEI/10.13039/501100011033 y por FEDER – Una manera de hacer Europa.

Bibliografía
- Díaz-Fernández, Á., Díaz-Losada, E., Moreno, D., Esperanza Valdés Sánchez, M.: “Anthocyanin profile of Galician endangered varieties. A tool for varietal selection”. Food Research International, 2022, 154. https://doi.org/10.1016/j.foodres.2022.110983
- Soltekin, O., Güler, A., Candemir, A., Altındişli, A., Unal, and A.: “Response of (Vitis vinifera) cv. Fantasy Seedless to water deficit treatments: Phenolic compounds and physiological activities”. BIO Web of Conferences, 2019, 15, 01001. https://doi.org/10.1051/bioconf/20191501001
- Moreno, D., Intrigliolo, D. S., Vilanova, M., Castel, J. R., Gamero, E., Valdés, E.:” Phenolic profile of grapevine cv. Tempranillo skins is affected by timing and severity of early defoliation”. Spanish Journal of Agricultural Research, 2021, 19(3). https://doi.org/10.5424/sjar/2021193-17089
- Vilanova, M., Santalla, M, Masa A.ASA, A.:” Environmental and genetic variation of phenolic compounds in grapes (Vitis vinifera) from northwest Spain”. The Journal of Agricultural Science, 2009, 147(6), 683-697. doi:10.1017/S0021859609990141
- Valdés, M. E., Puig, A., Muñoz, G., grupo MINORVIN y Moreno, D.: “Perfil fenólico de las variedades minoritarias tintas cultivadas en España. Impacto de la variedad y zona de cultivo”. Acta de Horticultura (SECH). IV Jornadas del Grupo de Viticultura. Pamplona, noviembre 2022. Pp 22-26.
- Boulton, R.: “The copigmentation of anthocyanins and its role in the color of red wine: a critical review”. American Journal of Enology and Viticulture, 2001. 52, 67–87. https://college.agrilife.org/talcottlab/wp-content/uploads/sites/108/2019/01/Review- Copigmentation.pdf
- Darías‐Martín, J.; Carrillo‐López, M.; Echavarri‐Granado, J.F. & Díaz‐Romero, C.: “ The magnitude of copigmentation in the colour of aged red wines made in the Canary Islands”. Food Res. Technol. 2007, 224, 643‐648. http://dx.doi.org/10.1007/s00217-006-0352-7
- Portu, J., López, R., Baroja, E., Santamaría, P. y Garde-Cerdán, T.: “Improvement of grape and wine phenolic content by foliar application to grapevine of three different elicitors: Methyl jasmonate, chitosan, and yeast extract”. Food Chemistry 2016, 201, 213-221. https://doi.org/10.1016/j.foodchem.2016.01.086
- Díaz-Fernández Á, Díaz-Losada E, Vázquez-Arias A, Pujol AP, Cardona DM, Valdés-Sánchez ME.: “Non-Anthocyanin Compounds in Minority Red Grapevine Varieties Traditionally Cultivated in Galicia (Northwest Iberian Peninsula), Analysis of Flavanols, Flavonols, and Phenolic Acids”. Plants (Basel). 2022 Dec 20; 12(1): 4. doi: 10.3390/plants12010004. PMID: 36616133; PMCID: PMC9824605.
- Castillo-Muñoz, N., Fernández-González, M., Gómez-Alonso, S., García-Romero, E. y Hermosín-Gutiérrez, I.: “Red-color related phenolic composition of Garnacha Tintorera (Vitis vinifera) grapes and red wines”. Journal of Agricultural and Food Chemistry 2009, 57, 7883-7891. https://doi.org/10.1021/jf9002736