Las reacciones de oxidación y reducción juegan un papel clave en la maduración del vino, en toda la fermentación, en depósito o en barrica, y más extensamente durante el envejecimiento en botella. Una medida de la tendencia de los componentes del vino a ser oxidados o reducidos sería de gran ayuda para el enólogo de cara a facilitarle la toma de decisiones sobre cómo debe manipularse un vino. El potencial redox registrado por un electrodo de platino ha sido presentado como la medida del estado de oxidación o reducción de un vino (Ribéreau-Gayon et al., 2000, Vivas et al., 1996). Algunos autores han reivindicado una conexión entre la calidad del vino y un bajo potencial redox, o han apuntado la necesidad de buscar un valor determinado para diferentes tipos de vino (Dikanovic-Lucan et al., 1995), otros no han podido encontrar una conexión con la calidad y han cuestionado la importancia de la medida para la producción práctica de vino (Rankine 1998). Sin embargo, ahora se encuentra disponible un diseño que reduce los problemas anteriores con el tiempo de medida y la estabilidad del electrodo (Vivas et al., 1996) y que fue adoptado por la Asamblea General de la OIV en 2000 (Resolución Oeno 3), por lo que la medida sigue siendo aplicada en los estudios del estado de oxidación o reducción de vinos (Del Alamo et al., 2006).
En este artículo se tiene se tiene en cuenta la oxidación principal y los procesos de reducción que ocurren en un electrodo de platino en el vino, en particular la oxidación de etanol acoplada al oxígeno o la reducción del protón, que indican que la medida tiene un valor limitado en la ciencia del vino. Este punto será desarrollado mediante la exposición de la teoría estándar de las medidas de potencial redox en las soluciones de iones de metales y usando los resultados para los estudios electroquímicos de vinos para diferentes materiales de electrodo (Tomlinson y Kilmartin 1997, Kilmartin y Zou 2001).
Valoraciones redox de iones metálicos
El empleo de electrodos de platino, para seguir el desarrollo de valoraciones redox, es habitualmente tratado en manuales de química analítica (por ejemplo, el de Skoog et al. 2004). En el caso de la oxidación de Fe2 por Ce4+:
![]()
el potencial (<em>E</em>) de conducción hasta el punto final viene dado por la ecuación Nernst para las especies de hierro en relación con el potencial de electrodo (Eo) en la escala estándar de hidrógeno (EEH, she en inglés):
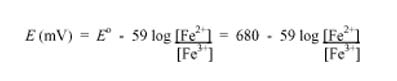
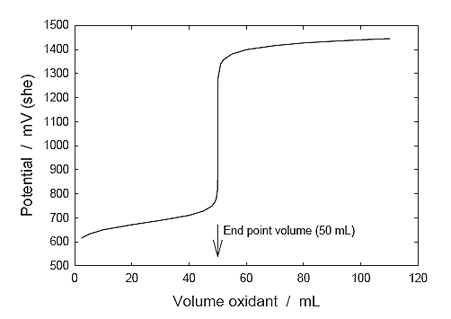
permitiendo que se forme la curva de valoración de la figura 1. A la inversa, en cualquier etapa que conduce hasta el punto final, el potencial de redox medido de la solución puede ser usado para determinar la proporción de Fe2+ a Fe3+, y el estado de oxidación o de reducción de las especies de hierro (por otra parte, es la cantidad de Fe2+ restante la que determina cuánto Ce4+ oxidante puede ser consumido).
Cuando se mide el potencial redox en una solución que contiene tanto iones Fe2+ como Fe3+, no hay ninguna corriente que fluya en el electrodo de platino, pero la situación está lejos de ser estática. El potencial redox puede ser visto como el punto en el cual las corrientes, debido a la oxidación de Fe2+ y la reducción de Fe3+ son iguales y contrarias, como se aprecia en la figura 2. En esta figura se ve cómo aumenta exponencialmente la magnitud de la corriente para un incremento lento (para la oxidación) o una disminución (para la reducción) en el potencial. Al valor absoluto de la corriente para el potencial en el cual las corrientes son iguales y contrarias se le denomina densidad de corriente de cambio, aunque no ocurra ningún cambio neto en la concentración de Fe2+ o Fe3+ (Bard y Faulkner 2001). La posición de cada curva para una corriente y un potencial dados depende de la cantidad de Fe2+ y Fe3+ presente, y el potencial más bajo obtenido en la figura 2b versus la figura 2a ilustran el efecto de una concentración creciente de Fe2+.
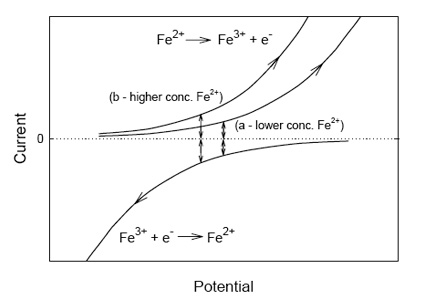
En una solución que contiene una mezcla de iones metálicos y otras especies activas como colorantes de indicador redox (por ejemplo, ferroína que cambia electrones con otros metales de forma rápida y reversible), las concentraciones de las formas oxidadas y reducidas de cada ion metálico se ajustan de modo que los potenciales dados por sus respectivas ecuaciones Nernst son los mismos. En esta situación ideal (el equilibrio que implica precipitados metálicos e iones complejos complica la situación), el potencial redox de una solución de iones metálicos, como un agua de suelo, debería proporcionar información útil sobre el estado de oxidación o reducción de la solución, pero esto puede limitarse a soluciones anaerobias (Eshel y Banin 2002) y a aquellas dominadas por el hierro (Grundl y Macalady 1989).
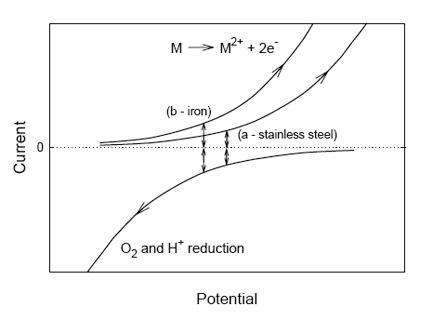
Cuando los procesos de oxidación y reducción que ocurren en un electrodo involucran especies diferentes, pueden ocurrir únicamente cambios químicos. Esto se aprecia cuando metales como el hierro son insertados en una solución acuosa; ahora el potencial de electrodo proporciona una medida comúnmente usada del índice de corrosión (Crow 1994). El potencial mixto que se desarrolla en este caso, también llamado circuito abierto o potencial de corrosión, ocurre en el punto en el cual las corrientes, debido a la oxidación metálica y la reducción de protones u oxígeno, son iguales y contrarias, como vemos en la figura 3. Se aprecian corrientes positivas mayores cuando la oxidación de un metal más activo (como el hierro versus un acero inoxidable) se acopla con una proporción más alta de procesos de reducción a un potencial inferior. Así, en una solución dada, un potencial de corrosión más bajo indica una proporción más alta de corrosión.
La electroquímica del vino
Estudios electroquímicos sobre electrodos de platino, oro y carbón en el vino nos llevan a concluir que el potencial redox en el vino debería ser visto como el punto en el cual la oxidación particular y los procesos de reducción en el electrodo están acoplados, más que como un punto estático (equilibrado) para todas las especies presentes.
Como parte de la investigación realizada para la medida del potencial redox de forma más rápida y reproducible, estudiamos el empleo de una amplia superficie de platino (negro) platinizado, como alternativa a los electrodos de platino pulidos (brillantes) que generalmente han sido usados en el vino (Tomlinson y Kilmartin 1997). El platino platinizado se usa como el electrodo estándar (en una solución de ácido de 1 M con gas de hidrógeno desbordándose a 1 atmósfera de presión) para proporcionar la escala universal de potenciales de electrodo, debido a la rapidez con la cual es establecido el potencial y su estabilidad (Skoog et al. 2004). Las lecturas obtenidas con los electrodos platinizados dieron valores de potencial redox bastante por debajo de los registrados en electrodos de platino brillantes, con una disminución constante en el potencial cuanto más platino negro se depositaba sobre la superficie del electrodo (Tomlinson y Kilmartin 1997). Una vez que fue establecido un valor inicial, se vio una variación en el potencial hacia valores más altos en el curso de varias horas, debido a la contaminación del electrodo por componentes del vino. La medida del potencial redox en el platino platinizado en 21 vinos (sin exposición al aire) presentó una fuerte correlación (r2=0,87) con el pH del vino. Como en experiencias anteriores, el potencial redox del vino aumentó con la aireación del vino, así, la agitación del vino supuso un aumento del potencial de unos pocos mV.
En un estudio posterior, las lecturas de los potenciales redox en electrodos de platino brillantes fueron comparadas con valores en otros dos electrodos inertes, oro y carbón vidrioso (Kilmartin y Zou 2001). De nuevo, en vez de producir la misma lectura, los potenciales en el oro fueron unos 40 mV más altos de promedio que los del platino, y otros 40 mV más altos en el carbón vidrioso. No se apreció mucha diferencia entre vinos tintos y blancos, indicando que los polifenoles presentes en vinos tintos (que son agentes reductores como parte de su actividad antioxidante) no son los principales determinantes del potencial redox.
Una nueva perspectiva acerca de los procesos que ocurren en los electrodos viene dada al examinar el potencial, aparte del potencial redox, y grabando la respuesta de la corriente.
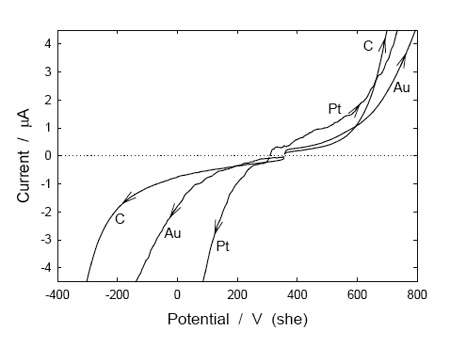
La figura 4 muestra voltamogramas típicos obtenidos en un vino blanco sauvignon blanc, para diferentes materiales de electrodo. Las corrientes catódicas para barridos de potenciales negativos (probablemente debido a la reducción de protón y oxígeno) eran mayores en el platino que en el oro, y más pequeñas otra vez en el electrodo de carbón. Al depurar con aire, las corrientes en el electrodo de platino aumentaron notablemente, con incrementos más moderados en los otros electrodos. La exploración del potencial en la dirección positiva también condujo a corrientes más altas en el electrodo de platino, hasta que se alcanzó un potencial de más de 600 mV (she) y el electrodo de carbón dio la corriente más alta. En este punto entra en juego la oxidación de polifenoles que contienen catecol, lo que ocurre fácilmente en el electrodo de carbón (Kilmartin et al., 2002). También se observó una corriente de oxidación más allá de 250 mV en el platino en una solución de vino modelo que contenía el 12 % (v/v) de etanol y 0,033 M de ácido tartárico con NaOH añadido para dar un pH 3,6 (pero con valores de corriente mucho más altos que en el vino blanco, donde especies adicionales de vino fueron adsorbidas en el platino bloqueando sitios de electrodos activos), indicativo de que la oxidación de etanol ocurrirá en el platino para valores de potencial redox vistos típicamente en vinos (Kilmartin y Zou 2001). La corriente medida, con el electrodo de platino en la solución de vino modelo, fue muy reducida en presencia de SO2, debido a la adsorción de especies que contienen azufre en la superficie del electrodo, lo que afecta a la eficacia de la oxidación del etanol –la influencia de adsorbatos añade un nivel adicional de complejidad a los valores de potencial redox–. Por otra parte, mencionar que la corriente medida con un electrodo de carbón en una solución de vino modelo era insignificante hasta que fueron aplicados potenciales mucho más altos (aproximadamente, 1000 mV).
El potencial redox del vino como potencial mixto
Las distintas lecturas de potencial redox obtenidas con diferentes materiales de electrodo indican que no hay un valor único para un vino determinado; ya que diferentes electrodos son catalíticamente activos para cierta s especies en el vino en distinto grado. El etanol es oxidado muy fácilmente en el platino, lo que lo hace un material de electrodo muy eficaz en aplicaciones de celda de combustible que implican pequeños alcoholes (Zhou et al. 2003). De la misma forma los protones y el oxígeno son reducidos de manera muy eficiente en el platino. Además, el potencial estándar para la oxidación de etanol a etanal (pH = 0 y concentraciones iguales de las dos especies) ha sido determinado como en unos 220 mV (she) (Clark 1960), que en el pH 3,5 se convierte a +15 mV, o con una concentración de etanol mil veces la del etanal, se obtiene un valor de -70 mV. Dado que los valores de potencial redox en el vino embotellado son más altos que éstos, típicamente de +100 a 300 mV en el platino brillante (Dikanovic-Lucan et al., 1995), y por debajo de 0 mV en el pH 3,5 para el platino platinizado (Tomlinson y Kilmartin 1997), la oxidación de etanol se supone (en el platino en el vino) a estos valores de potencial. Por otra parte, estos potenciales son demasiado bajos para la oxidación de polifenoles de vino (Kilmartin et al., 2002). Mientras otras especies en el vino, incluyendo iones metálicos, también pueden ser oxidadas y reducidas en el potencial redox, los altos niveles de etanol, protones y a veces oxígeno, y su alta electroactividad, significan que el potencial redox en el vino puede ser explicado como un potencial mixto que involucra estas especies. El concepto de potenciales mixtos en medidas con electrodos de platino ha sido perfilado por Durliat y Comtat (2005), con una consideración a la influencia del oxígeno disuelto.
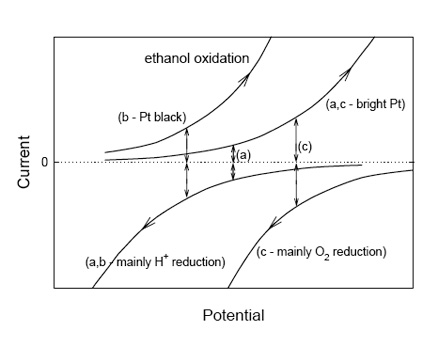
En la figura 5 el potencial en el punto (a) representa el acoplamiento de la oxidación del etanol y la reducción del protón en un electrodo de platino brillante; como sucede en una botella de vino con niveles muy bajos de oxígeno disuelto. En cambio, cuando se usa un electrodo de platino negro, las corrientes para la oxidación de etanol son mucho más altas en cada valor potencial, y el potencial redox mixto ocurre en un valor mas bajo (b) que para el platino brillante (la curva para la reducción del protón también habrá cambiado a valores de corriente más negativos, pero podemos asumir que el efecto sobre la oxidación del etanol es mayor). El efecto de un aumento del pH tanto sobre la oxidación del etanol como sobre la reducción del protón (en cualquier potencial particular) debe hacer que la corriente de oxidación del etanol sea más positiva y la reducción del protón menos negativa, lo cual tiene el efecto de mover el potencial mixto a valores más bajos. La fuerte correlación lineal entre el potencial redox con el pH observada en los electrodos de platino negro (y una correlación más débil en el platino brillante) es compatible con esta perspectiva y sugiere que la lectura estaba dominada por el etanol y el contenido ácido (Tomlinson y Kilmartin 1997). Cuando se introduce oxígeno en un vino, una gran corriente (debida a la reducción de oxígeno) puede acoplarse con una corriente más grande para la oxidación del etanol (fig. 5, punto c) para dar una lectura de potencial redox más alta. Por otro lado, la agitación puede aumentar las corrientes de reducción , lo que conduce al pequeño aumento del potencial observado experimentalmente.
En ausencia de un catalizador de platino, la oxidación del etanol en el vino no ocurre con rapidez, pues parece requerir la oxidación acoplada de polifenoles y la presencia de hierro y cobre como iones catalíticos (Wildenradt y Singleton 1974, Danilewicz 2007). Los polifenoles son los principales sustratos de interés para la oxidación del vino, pero no son oxidados en el platino con los valores de potencial redox comúnmente encontrados en el vino, por lo tanto debe cuestionarse la importancia de mediciones de potencial redox para el envejecimiento del vino. En el mejor de los casos puede proporcionar una medida grosera del contenido de oxígeno de un vino o un mosto experimentando fermentación (Berovic et al., 2003). Siempre puede hacerse una medida más exacta de oxígeno disuelto usando sondas específicas como el electrodo de Clark (Vidal et al., 2003). Muchas afirmaciones en los textos de enología en los cuales se menciona el potencial redox serán también válidas si son sustituidas por afirmaciones sobre niveles de oxígeno. Por ejemplo, la reivindicación por la cual un bajo potencial redox conduce a la producción de azufre reducido inodoro en algunos vinos (Jackson 2000), puede ser replanteada diciendo que niveles (muy) bajos de oxígeno disuelto conducen a la producción de azufre reducido inodoro. El cambio de valores de potencial redox durante la fermentación puede, del mismo modo, ser replanteado como cambios en niveles de oxígeno.
Una aplicación más prometedora de potenciales redox con bebidas ha sido el uso reciente de medidas en un electrodo de platino en la «fermentación» de los tés, donde se observó con éxito la transformación de polifenoles de té verde en teaflavinas de té negro y compuestos relacionados (Chen et al., 2007). En ausencia de oxidación del etanol en el electrodo de platino, la proporción de catecol de polifenol y grupos galoil en las formas de quinona oxidada bien pueden ser responsables del cambio en los valores de potencial redox observados durante la fermentación del té.
El potencial redox en sistemas biológicos también ha sido criticado debido a la carencia de sistemas de equilibrio reversibles (Kohen y Nyska 2002). Estos autores promueven una medida de la energía reductora dada por la concentración de equivalentes reductores presentes y determinada usando voltamperometría en un electrodo inerte. Volviendo al ejemplo de la oxidación de Fe2+ por Ce4+, esto es equivalente a la suma del oxidante requerido para completar la valoración, a diferencia de la proporción de Fe2+ a Fe3+ en cualquier punto determinado. Una medida de este tipo es obtenida para el vino en el ensayo Folin-Ciocalteu para polifenoles totales y por la intensidad de picos dados por la voltamperometría (Kilmartin et al., 2002, Piljac et al., 2004, Rodrigues et al., 2007, Petrovic 2009, Makhotkina y 2009 Kilmartin). La oxidabilidad del vino en estos casos está relacionada principalmente con el contenido de polifenol, y con el papel clave que ejercen los polifenoles en la maduración de vino.
Bibliografía
. Bard A.J., Faulkner L.R. Electrochemical methods. Fundamentals and applications. John Wiley & Sons, New York, 2001.
. Berovic M., Mavri J., Wondra M., Kosmerl T., Bavcar D. «Influence of temperature and carbon dioxide on fermentation of Cabernet Sauvignon must». Food Technology and Biotechnology 2003; 41: 33-359.
. Chen P.C., Chang F.S., Chen I.Z., Lu F.M., Cheng T.J., Chen R.L.C. «Redox potential of tea infusion as an index for the degree of fermentation». Analytica Chimica Acta 2007; 594: 32-36.
. Clark W.M. Oxidation-reduction potentials of organic systems. Williams & Wilkins Co.: Baltimore, 1960.
. Crow D.R. Principles and applications of electrochemistry. Blackie Academic & Professional, London, 1994.
. Danilewicz J.C. «Interaction of sulfur dioxide, polyphenols and oxygen in a wine-model system: central role of iron and copper». American Journal of Enology and Viticulture 2007; 58: 53-60.
. Del Alamo M., Nevares I, Carcel M. «Redox potential evolution during red wine aging in alternative systems». Analytica Chimica Acta 2006; 563: 223-228.
. Dikanovic-Lucan Z, Palic A. «Le potential redox dans le processus de vinification : un bilan». Bulletin OIV 1995; 775-776: 762-779.
. Durliat H, Comtat M. «Critical evaluation of potentiometric redox titrations in enology». Analytica Chimica Acta 2005; 545: 173-181.
. Eshel G, Banin A. «Feasibility study of long-term continuous field measurement of soil redox potential». Communications in Soil Science and Plant Analysis 2002; 33: 695-709.
. Grundl T.J, Macalday D.L. «Electrode measurement of redox potential in anaerobic ferric/ferrous chloride systems». Journal of Contaminant Hydrology 1989; 5: 97-117.
. Jackson R.S. Wine Science. Principles, practice, perception. Academic Press, San Diego, 2000.
. Kilmartin P.A, Zou H. «The effect of electrode material on the measured redox potential of red and white wines». Electroanalysis 2001; 13: 1347-1350.
. Kilmartin P.A., Zou H, Waterhouse A.L. «Correlation of wine phenolic composition versus cyclic voltammetry response». American Journal of Enology and Viticulture 2002; 53: 294-302.
. Kohen R., Nyska A. «Oxidation of biological systems: oxidative stress phenomena, antioxidants, redox reactions, and methods for their quantification». Toxicologic Pathology 2002; 30: 620-650.
. Makhotkina O., Kilmartin P.A. «Uncovering the influence of antioxidants on polyphenol oxidation in wines using an electrochemical method: cyclic voltammetry». Journal of Electroanalytical Chemistry 2009; 633: 165-174.
. Petrovic S.C. «Correlation of perceived wine astringency to cyclic voltammetric response». American Journal of Enology and Viticulture 2009; 60: 373-378.
. Piljac J., Martínez S., Stipcevic T., Petrovic Z., Metikos-Hukovic M. «Cyclic voltammetry investigation of the phenolic content of Croatian wines». American Journal of Enology and Viticulture 2004; 55: 417-422.
. Rankine B. Making good wine. A manual of winemaking practice for Australia and New Zealand. Sun Pan Macmillan, Melbourne, 1998.
. Ribéreau-Gayon P., Glories Y., Maujean A., Dubourdieu D. «Aging red wines in vat and barrel: phenomena occurring during aging». A: Handbook of Enology. Vol. 2. Wiley, Chichester, 2000: 353-391.
. Rodrigues A., Silva Ferreira A.C., Guedes De Pinho P., Bento F, Geraldo D. «Resistance to oxidation of white wines assessed by voltammetric means». Journal of Agricultural and Food Chemistry 2007; 55: 10557-10562.
. Skoog D.A., West D.M., Holler F.J, Crouch S.R. Fundamentals of Analytical Chemistry. Thomson: Australia, 2004.
. Tomlinson J.W, Kilmartin P.A. «Measurement of the redox potential of wine». Journal of Applied Electrochemistry 1997; 27: 1125-1134.
. Vidal J.-C., Boulet J.-C, Moutounet M. «Oxygenation of wine during processing treatments. Data from cellar operations». Part 2. Revue Française d’Oenologie 2003; 201: 32-38.
. Vivas N., Glories Y., Bertrand A., Zamora, F. «Principe et méthode de mesure du potentiel d’oxydoréduction dans les vins». Bulletin OIV 1996; 785-786: 617-633.
. Wildenradt H.L, Singleton V.L. «Production of aldehydes as a result of oxidation of polyphenolic compounds and its relation to wine aging». American Journal of Enology and Viticulture 1974; 25: 119-126.
. Zhou W., Zhou Z., Song S., Li W., Sun G., Tsiakaras P, Xin Q. «Pt based anode catalysts for direct ethanol fuel cells». Applied Catalysis B : Environmental 2003; 46: 273-285.