Mucho se ha hablado durante los últimos años sobre la importancia de conocer el potencial de oxidorreducción del vino para de este modo controlar mejor su conservación y optimizar su crianza.1-6 De hecho ya en 1962, en el décimo Congreso Internacional de la OIV, en Tbilisi (Georgia) la Comisión de Enología decidió expresar el estado de oxidorreducción de los vinos mediante el valor de su potencial de oxidorreducción (EH) y posteriormente estableció los protocolos necesarios para su análisis oficial.7,8 Ahora bien, como cualquier parámetro químico-físico, el potencial de oxidorreducción representa un concepto difícil de comprender que precisa ciertas aclaraciones.
En ese sentido hay que señalar que en el mundo del vino se ha utilizado en ocasiones este concepto de una manera muy alegre y no siempre de forma del todo correcta. Así, por ejemplo, el término «vino reducido» induce a confusión ya que se utiliza indistintamente para describir aquellos vinos con un EH bajo y también a los que presentan un defecto olfativo relacionado con la presencia de ácido sulfhídrico, mercaptanos y otras substancias azufradas. Evidentemente muchos de estos compuestos azufrados se generan a potenciales de oxidorreducción bajos, pero afortunadamente no todos los vinos que tienen un EH bajo llegan a generar dichos defectos o de lo contrario todos los vinos embotellados presentarían olores de reducción. La realidad es por tanto mucho más compleja y por ello creo necesario clarificar algunos conceptos.
En primer lugar es necesario señalar que la determinación del potencial de oxidorreducción no es un asunto fácil. Para su determinación se emplean dos electrodos, uno de medida que generalmente es de platino, y otro de referencia que suele ser de plata o de calomelanos.5 No obstante, el contacto del vino con los electrodos provoca el envenenamiento de los mismos, lo que interfiere la medida y obliga a una limpieza exhaustiva de los mismos. En general lo que se suele apreciar es que el potencial deriva continuamente sin llegar a estabilizarse la medida.3,7 Por esta razón, la OIV ha normalizado su medida mediante el uso de electrodos combinados de doble camisa que permiten una mayor estabilidad de la medida.8,9
El potencial de oxidorreducción, de acuerdo con las leyes de la termodinámica viene definido por la siguiente ecuación:
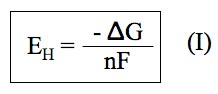
Donde ΔG representa el incremento de la energía libre de Gibbs, n es el número de electrones que se intercambian y F es la constante de Faraday. Las leyes de la termodinámica establecen que para que un proceso tenga lugar tiene que haber una disminución del ΔG. Por tanto, en el caso de una reacción de oxidorreducción, su EH tendrá que ser positivo y cuanto más alto sea mayor será la tendencia a que tenga lugar. Traduciendo este concepto a términos más sencillos y aplicables al mundo del vino, equivaldría a decir que cuanto mayor sea el EH de un vino, mayor será su tendencia a oxidarse. Asimismo, cuando menor sea su EH, mayor será su tendencia a reducirse.
El potencial de oxidorreducción de una solución se rige por la ley de Nernst10 que aplicada a una reacción de oxidorreducción simple daría lugar a la siguiente expresión:

Claro está que el vino no es una solución simple y que, por tanto, en él coexisten numerosos pares de oxidorreducción. Resulta así obvio que cualquier intento de modelizar matemáticamente el comportamiento del EH del vino es sumamente complicado.
Por esta razón intentaremos inicialmente entender el comportamiento del EH del agua, componente mayoritario del vino, para posteriormente introducir el comportamiento del EH del vino, así como la influencia de algunos de sus componentes sobre dicho EH.
La principal reacción de oxidorreducción en el agua es la siguiente:8,11,12
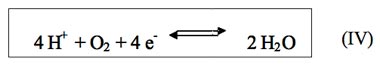
Por lo que la expresión de Nernst quedaría como:
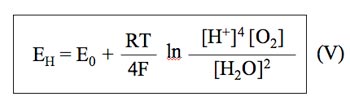
Si consideramos los siguientes datos para el agua destilada a 25 ºC:
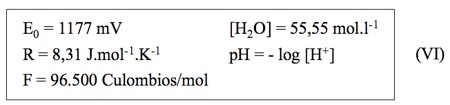
Se obtiene la siguiente expresión final:
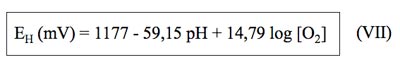
Donde se puede ver claramente que el EH del agua depende de su pH y de su concentración en oxígeno.
Evidentemente, el vino representa una matriz mucho más compleja que el agua destilada en la que participan múltiples reacciones de oxidorreducción. No obstante, se puede afirmar que el EH del vino también depende en gran medida de su pH y especialmente del oxígeno presente en disolución. Así, la figura 112 ilustra la influencia del oxígeno disuelto y del pH sobre el potencial de oxidorreducción de un medio hidroalcohólico modelo (etanol: 13 %; ácido tartárico: 4 g/L).
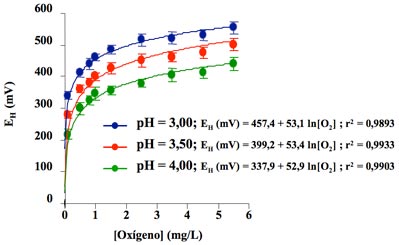
En dicha gráfica se puede comprobar que el EH aumenta enormemente al incrementarse la concentración de oxígeno disuelto y que también aumenta a medida que disminuye el pH. Por esta razón, la determinación del EH sin tener en cuenta el pH del medio y sobre todo su concentración en oxígeno carece de sentido.7
Por otra parte, la realidad es mucho más compleja ya que el oxígeno disuelto en el vino es consumido por este a través de las múltiples reacciones posibles. Cuando esto ocurre los diversos pares redox existentes en el vino que presenten un potencial de reducción inferior al de la reducción del oxígeno en medio ácido (reacción IV) serán desplazados hacia la oxidación de acuerdo con el siguiente esquema genérico.
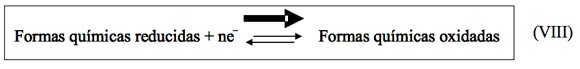
Si tomamos el ejemplo de par redox Fe+3/Fe+2 y lo comparamos con la reacción de reducción del oxígeno.
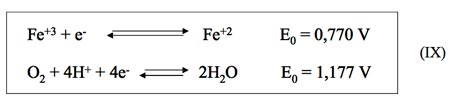
podemos ver que el potencial de reducción del hierro es inferior al del oxígeno. Por consiguiente, el Fe+2 será oxidado por el oxígeno a Fe+3 de acuerdo con la siguiente reacción global.
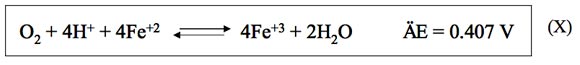
y lo mismo ocurriría con otros pares redox con un potencial de reducción inferior al del oxígeno. De este modo el oxígeno es consumido y de acuerdo con lo que se indica en la Figura 1 el EH debería disminuir. No obstante, esto no ocurre inmediatamente ya que el conjunto de formas químicas oxidadas del conjunto de pares redox activos del vino se incrementa. En resumen, la ecuación que define el potencial de oxidorreducción del vino se puede aproximar a la siguiente adaptación de la ley de Nernst.12,13

Poco a poco, si no hay una nueva disolución de oxígeno, las formas químicas oxidadas de los diversos pares redox volverán a reducirse lo que provocará la oxidación de otros componentes del vino como pueden ser aromas, compuestos fenólicos, etc. Estos fenómenos descritos son de hecho el comienzo de los procesos que tienen lugar cuando aportamos oxígeno al vino, ya sea mediante trasiegos, crianza en barrica o microoxigenación. Ahora bien, como que muchos de estos compuestos que se oxidan no son capaces de intercambiar electrones como el par redox Fe+3/Fe+2, el EH del vino disminuirá paulatinamente, pudiendo alcanzar en medios muy anaeróbicos valores realmente muy bajos. Tal es el caso de los vinos embotellados o de los vinos conservados en depósitos de acero inoxidable durante largo tiempo.
La adición al vino de ciertos productos antioxidantes como el dióxido de azufre, el ácido ascórbico o el glutatión presenta naturalmente un efecto sobre el potencial de oxidorreducción. La figura 2 ilustra dicho efecto.12,14
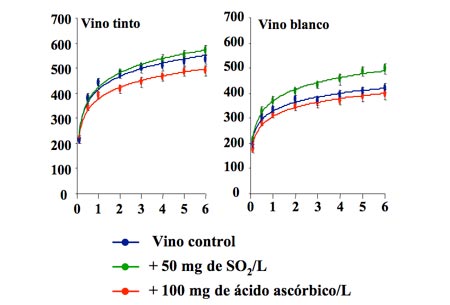
Como se puede ver, el ácido ascórbico disminuye claramente el EH tanto en vinos blancos como en vinos tintos, especialmente a altas concentraciones de oxígeno en el medio. Por tanto, el efecto protector contra la oxidación del ácido ascórbico es doble ya que por una parte elimina parte del oxígeno por reacción directa, y por otra provoca una disminución directa del EH. Sin embargo, algunos autores sostienen que el ácido ascórbico solamente representa una protección a corto término, ya que a largo término puede provocar incluso una mayor oxidación debido a que puede generar la aparición de peróxidos.15 Por su parte, la presencia de dióxido de azufre genera una disminución del EH en el vino blanco similar a la del ácido ascórbico, pero apenas lo disminuye en los vinos tintos. Este diferente efecto del SO2 podría estar relacionado con la presencia de antocianos en el vino tinto, ya que estos se combinan con este aditivo y probablemente anulen su efecto directo sobre el potencial de oxidorreducción.12,14
Por otra parte, el contacto con las lías o el empleo de otro aditivo antioxidante que últimamente esta siendo muy utilizado para proteger el mosto de la oxidación, como es el glutatión, también generan una disminución del EH,14 que incluso puede provocar en ocasiones la aparición de desagradables olores de reducción.
Finalmente, quisiera finalizar aclarando la relación que existe entre el EH y la aparición de olores de reducción. La presencia en el vino de substancias azufradas susceptibles de generar olores desagradables depende de múltiples factores de entre los que destacaríamos los siguientes:16
-
- Carencia de nitrógeno fácilmente asimilable durante la fermentación alcohólica.
- Degradación de los aminoácidos azufrados (cisterna y metionina)
de las proteínas celulares de las levaduras en caso de un contacto
muy prolongado del vino con las lías en condiciones anaeróbicas. - Degradación de residuos de pesticidas presentes en el vino.
- Incidencia de la radiación (goût de lumière).
Estos son probablemente las causas más estudiadas, si bien muy probablemente existen otras causas que desconocemos completamente. El caso es que nuestros vinos pueden, y por desgracia acostumbran, a oler mal en ocasiones debido a la aparición de ácido sulfhídrico y otras moléculas azufradas. Los enólogos suelen airear inmediatamente mediante un trasiego o aplicando oxígeno (macro y/o microoxigenación) lo que generalmente conduce a la desaparición del defecto. No obstante, cuando el vino consume el oxígeno y el potencial de oxidorreducción vuelve a descender, el problema suele volver a aparecer. Y si esto ocurre tras el embotellado, el problema puede llegar a ser grave. La razón de este comportamiento se puede explicar mediante el ejemplo de un par redox tal y como se muestra en la figura 3.
Básicamente, el metanotiol en presencia de oxígeno y a un EH suficientemente alto se oxida a dimetil disulfuro. Esto ocurre cuando trasegamos el vino y como que el umbral de percepción del dimetil disulfuro es 60 veces superior al del metanotiol, por lo general el mal olor desaparece. Ahora bien, cuando el EH vuelve a descender, tal y como se ha comentado en las líneas precedentes, la reacción puede revertir y al regenerarse el metanotiol el olor de reducción vuelve a aparecer.
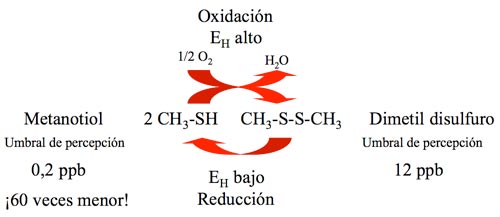
Este ejemplo del par redox metanotiol no es el único que puede existir en el vino, pero sirve de ilustración al problema. El potencial de oxidorreducción forzosamente bajará cuando embotellemos el vino y si estas moléculas están presentes necesariamente aparecerán los desagradables olores de reducción.
Estos problemas se han solucionado clásicamente aconsejando la decantación del vino un cierto tiempo antes de consumirlo, lo que revertiría la reacción descrita, o bien adicionando sulfato de cobre al vino justo antes del embotellado. El cobre es muy efectivo ya que secuestra todas las moléculas con grupos tiol, pero presenta tres inconvenientes:
-
- Un exceso de cobre puede originar precipitados.
- El Cu+/Cu+2 es también un par redox y un aumento de su concentración favorece la oxidación del vino.
- El cobre también secuestra algunas moléculas azufradas que presentan interesantes aromas como la 4-SH-4-Metil-pentanona; el 3-SH-hexanol; el acetato de 3-mercaptohexilo o el furfuriltiol.16
Por esta razón, el problema debería de ser solucionado antes para evitar la presencia del metanotiol y otras moléculas azufradas. De este modo, la reducción en la botella no nos daría ningún susto y permitiría su correcta y larga evolución.
Bibliografía
1. Geloso J. Relation entre le viellissement des vins et leur potentiel d’oxydoréduction. Ann Brasser Dist 1931; 29: 177-193.
2. Ribéreau-Gayon J. Oxydation et réduction dans les vins. Thèse Docteur en sciences physiques. Université de Bordeaux, 1933.
3. Deibner L. Recherche sur les techniques de mesure du potentiel d’oxydoréduction dans le jus de raisin et les vins (1956). Ann Technol Agric 1981; 22: 77-90.
4. Pontallier P. Recherches sur les conditions d’élevage des vins rouges. Rôle des phénomènes oxydatifs. Thèse Docteur-Ingénieur. Université de Bordeaux II, 1981.
5. Ribéreau-Gayon P., Glories Y., Maujean A., Dubourdieu D. L’élevage des vins rouges en cuve et en fût. Les phénomènes du viellissement. En: Traité d’œnologie. Tomo 2. Chimie du vin, Stabilization et traitements. Ed. Dunod, París, 1998: 451-500.
6. Feuillat M., Naudin R., Peyron D. Ëlevage des vins sous bois: expérimentations en Bourgogne. En: Œnologie: Fondements scientifiques et technologiques. Ed. Claude Flancy, Lavoisier, París, 1998: 1027-1044.
7. Zamora F. Contribution a l’étude des phénomènes d’oxydation du vin. Mémoire de DEA Œnologie-Ampélologie. Université de Bordeaux II, 1989.
8. Vivas N., Glories Y., Bertrand A., Zamora F. Principe et méthode de mesure du potentiel d’oxydoréduction dans les vins. Bulletin de l’OIV 1996; 785-786: 618-633.
9. OIV. Résolution oeno 3/2000.
http://news.reseau-concept.net/images/oiv/Client/MA-F-AS2-06-POTOXY.pdf
10. Nernst W. Traité de Chimie Genérale. Propietés générales des Corps. Atome et Molécule. Libraire Scientifique J. Hermann, París, 1922.
11. Glories, Y., Zamora F. Étude des facteurs dont depend le potentiel d’oxydoreduction du vin. Rapport d’Activités de Recherche 1988-1990. Institut d’Œnologie. Université de Bordeaux, 1991: 95-96.
12. Vivas N., Zamora F., Glories Y. Étude des phénomenes d’oxydorreduction dans les vins. Mise au point d’une méthode rapide de mesure du potentiel d’oxydorreduction. J Int Sci Vigne Vin 1992; 26: 271-285.
13. Vivas N., Saint-Cricq de Gaujeac N., Zamora F. Experimental principe to evaluate the degree of oxydation or reduction balance in wines. Journal des Sciences et Techniques de la Tonnellerie 1999; 5: 65-76.
14. Vivas N., Zamora F., Glories Y. Incidence de certains facteurs sur la consommation de l’oxygène et sur le potentiel d’oxydorreduction dans les vins. J. Int. Sci. Vigne Vin 1993; 27: 23-34.
15. Skouroumounis G.K., Kwiatkowski M.J., Francis I.L. et al. 2005. The influence of ascorbic acid on the composition, colour and flavour properties of a Riesling and a wooded Chardonnay wine during five years storage. Aus J Grape Wine Res 2005; 11: 355-368.
16. Darriet P., Lavigne V., Tominaga T. Un paradoxe, les composés soufrés volatils responsables des defauts et de qualité dans les vins. J. Int. Vigne Vin, la degustation, 1999 (Nro hors de série).