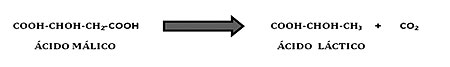
La fermentación maloláctica (FML) es un proceso que se puede dar de manera natural en los vinos una vez finalizada la fermentación alcohólica (FA), debido a la presencia de bacterias lácticas (BAL). Estas bacterias transforman el ácido málico en ácido láctico y la especie principalmente responsable de este proceso es Oenococcus oeni [1]. El ácido láctico contiene sólo un grupo ácido, en lugar de dos del ácido málico, proporcionando un gusto más agradable y suave, disminuyendo además la acidez total del vino. Esta transformación se realiza mediante el enzima maloláctico que contienen las BAL del vino [2], y puede verse afectada por diferentes factores que determinan el crecimiento de estas bacterias como la temperatura, el contenido en sulfuroso libre, el grado alcohólico y el pH del vino. En estos últimos años el cambio climático también se ha convertido en un factor de gran repercusión en el proceso de la FML, ya que el incremento de las temperaturas ambientales en nuestras latitudes, que afectan al ciclo vegetativo de la vid, conlleva un incremento de azúcares en el mosto y vinos con mayor graduación alcohólica. Debido a esto, las BAL como O. oeni tienen mayores dificultades para realizar la FML, por lo que se requiere un mejor conocimiento de los mecanismos de adaptación de las BAL a estas condiciones estresantes [3].
Por diversas causas, en los últimos años la industria enológica ha sufrido una transformación importante, convirtiéndose en un sector de constantes cambios e innovaciones. Las dificultades para llevar a cabo la FML han promovido el estudio y desarrollo de diferentes tecnologías para llevar a cabo el proceso, desde las más tradicionales, incluyendo el uso de cultivos iniciadores liofilizados, hasta las más innovadoras, aún en desarrollo, como son los cultivos inmovilizados en distintos soportes, pasando por la coinoculación de levadura-bacteria, de creciente aplicación en la actualidad.
El proceso biotecnológico para llevar a cabo la FML de más amplia aplicación en enología es la inoculación de cultivos iniciadores seleccionados de O. oeni. En los años noventa, se introdujeron en el mercado enológico estos productos para llevar a cabo la FML, comenzando con algunos que necesitaban una fase de acondicionamiento preliminar de las bacterias en la bodega antes de su utilización. Posteriormente se desarrollaron los cultivos iniciadores con una única etapa de adaptación, en los cuales el producto consta de bacterias seleccionadas liofilizadas, ya pre-aclimatadas y por un activador. Después se desarrollaron los cultivos de inoculación directa que se introdujeron en la industria a principios del año 2000. En estos tan solo se necesita una simple rehidratación antes de la inoculación en el vino, facilitando así su aplicación. Más recientemente, se ha diseñado una estrategia para facilitar todavía más la labor del enólogo en el momento de la inoculación del cultivo iniciador; son los cultivos líquidos de la especie O. oeni. Estos cultivos no sufren el tratamiento de secado ni liofilización como ocurre con los cultivos iniciadores tradicionales, garantizando un mayor número de células viables activas desde el mismo momento de la inoculación. Por ello, este nuevo método facilita la implantación del inóculo, se adelanta el inicio de la FML, y disminuye los riesgos de alteraciones microbianas y las posibles pérdidas de los aromas.
Sin embargo, existen vinos en los que las condiciones que se dan tras la FA son demasiado adversas para el desarrollo óptimo de O. oeni. La búsqueda de alternativas a la FML tradicional tras la FA llevó al desarrollo de una nueva técnica: la coinoculación levadura-bacteria maloláctica. Esta técnica está basada en la inducción de la FML durante el transcurso de la FA, pudiendo inocularse las bacterias en diferentes momentos de ésta. Los inicios de aplicación de esta técnica estuvieron dominados por el miedo de la industria enológica, ya que se consideraba que la adición de bacterias lácticas antes de la finalización de la FA entrañaba un riesgo muy elevado, ya que durante este periodo las BAL podían consumir azúcares y generar un picado tanto láctico como acético, debido al metabolismo heterofermentativo de O. oeni.
En cambio, en la actualidad es una técnica de gran aplicación en la industria enológica, demostrando la mejoría del proceso y desbancando los miedos iniciales en el sector. Además, los trabajos realizados en investigación enológica hasta la fecha muestran que la coinoculación aporta una serie de ventajas con respecto a la inoculación secuencial, utilizada de forma tradicional. Por un lado, se obtiene una buena implantación de la bacteria maloláctica, debido a que las condiciones del mosto son más favorables para el desarrollo de la bacteria que las del vino, y las bacterias tienen la oportunidad de aclimatarse progresivamente a las condiciones de realización de la FML. Además, se mantiene controlada la población de microorganismos durante la vinificación, sin dejar la etapa entre final de FA y principio de FML sin población de bacterias seleccionadas, como ocurre frecuentemente en la inoculación secuencial, evitando así el desarrollo de microorganismos perjudiciales. La aplicación se puede realizar mediante la inoculación de cultivos iniciadores mixtos, lo cual también facilita la manipulación para el enólogo, ya que ambos microorganismos se inoculan al mismo tiempo. Esta tecnología también proporciona al proceso de vinificación velocidad y seguridad, llegando a término la FML entre 0 y 14 días después de la FA en condiciones óptimas, pudiendo realizar un temprano sulfitado que puede realizarse después de la FML, es decir, poco después del fin de la FA. Por tanto, el vino queda protegido en poco tiempo frente a contaminaciones microbianas, sin necesidad de largos tiempos de espera para la realización de la FML cuando ésta se realiza de forma secuencial.
Contando pues con distintas técnicas, al enólogo se le abre un abanico de posibilidades basándose en las características del vino a elaborar, pudiendo determinar el momento de inoculación de las BAL. Si se opta por la coinoculación, la inoculación de la bacteria maloláctica puede realizarse en dos momentos distintos dependiendo de la situación enológica. En el caso de querer elaborar un vino de rotación rápida (vino joven) o disponer de una FA bien controlada, se recomienda realizar una coinoculación precoz, es decir, a las 24-48 horas del inicio de la FA, mientras que si se trata de un vino con pH alto, alta carga microbiana u otras condiciones fisicoquímicas desfavorables para la FML, se recomienda realizar una inoculación tardía. También, el enólogo puede optar por una coinoculación secuencial en los casos en que observen condiciones físico-químicas favorables para la FML, condiciones para la FA arriesgadas, vino elaborado a partir de variedades con color inestable o cuando vaya a realizar la FML en barrica sobre lías.
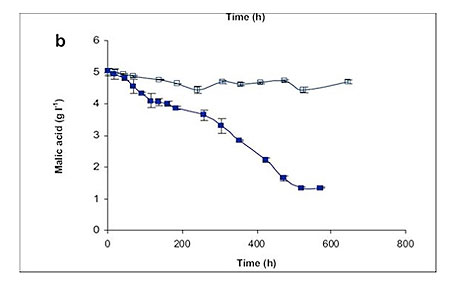
En cuanto al impacto que genera la coinoculación de BAL con levaduras en las diferentes variables de la vinificación, numerosos trabajos mostraron que <i>Saccharomyces cerevisiae</i> no resultaba afectada por la inoculación simultánea de bacterias durante la FA, pudiendo acabar la fermentación al mismo tiempo que los vinos tradicionales. Sin embargo, se observó que 20 días después de terminar la FA/FML simultánea, no se detectaron ni glucosa ni fructosa con el protocolo de la coinoculación, mientras que en la coinoculación secuencial, la glucosa y la fructosa quedaban con una concentración residual conjunta de 700 mg/L [4-5]. La coinoculación añade pues la ventaja de que la completa ausencia de estos dos azúcares incrementa la estabilidad microbiológica del vino. Además, el tiempo en el que se realiza la FML es mucho más corto cuando se utiliza la coinoculación que en los vinos tradicionales. Esto implica otra importante ventaja porque el vino queda terminado en un corto periodo de tiempo, con lo cual el está el mínimo tiempo expuesto al posible desarrollo de microorganismos indeseables. Según Krieger et al., un vino realizado mediante coinoculación acabaría en torno 20-30 días mientras que un vino tradicional tardaría 70-80 días [4]. Nehme et al., también demostraron que la tasa de consumo del ácido málico durante el cocultivo es 2,82 veces más rápida que en solitario y tras la FA, lo cual demuestra que esta estrategia resulta más favorable para el metabolismo de la bacteria (fig. 1) [6].
En cuanto a variables como la acidez total, estudios realizados como los de López et al. demostraron que ésta resulta mayor en vinos coinoculados, como consecuencia de una menor disminución del ácido tartárico durante el proceso de elaboración[7]. En vinos coinoculados, la intensidad de color fue significativamente menor debido a una menor proporción de antocianos coloreados y a una menor polimerización. En cambio, los vinos con inoculación secuencial mostraron mayor intensidad y estabilidad del color[7]. En el análisis químico de la composición aromática se comprobó que en los vinos elaborados mediante coinoculación tenían una mayor concentración de acetato de etilo, alcoholes superiores, acetatos y ésteres, y menor de acetoína y butirolactona, lo que suponía una mejora aromática y mayor carácter afrutado [7]. Del mismo modo, se realizaron multitud de análisis organolépticos de vinos coinoculados para comprobar su calidad final frente al consumidor. Los expertos catadores destacaron que los vinos mejor valorados eran los elaborados con coinoculación a las 12 horas de iniciar la FA, destacando los aromas afrutados y varietales frente al carácter verde que predominaba en el testigo de la FML espontánea. Se observó que cuanto más tardía era la coinoculación, más destacaban las notas lácticas, incrementando también la estructura y el amargor a medida que se retarda la inoculación [8]. En cambio, los resultados de López et al. del análisis organoléptico mostraron una preferencia en la fase olfativa hacia los vinos inoculados con bacteria en el mosto, pero una mejor valoración en la fase gustativa en los inoculados al final de la FA, aunque en ambos casos se englobaron en la categoría “Bien”[7].
Para ofrecer un mayor abanico de posibilidades al sector enológico y continuar mejorando el difícil proceso de la FML se siguen desarrollando otras técnicas alternativas para la inducción de ésta. Nuevas tendencias apuntan al uso de cultivos iniciadores de BAL inmovilizadas. Esta tecnología proporciona numerosas ventajas en comparación con la utilización de células libres, ya que el soporte de inmovilización actúa como un agente de protección contra los efectos fisicoquímicos del pH, la temperatura, solventes o incluso metales pesados, prolongando así la actividad y estabilidad celular. La alta concentración de bacterias de estos sistemas permite tiempos de fermentación más cortos, la eliminación de la fase de crecimiento y procesos en continuo. Del mismo modo, facilita la fermentación a bajas temperaturas, aumentando la calidad del vino, permite una fácil recuperación, regeneración y reutilización del producto inmovilizado y reduce el riesgo de contaminaciones microbianas debido a las altas densidades celulares iniciales [9].
Prueba de ello son los numerosos trabajos que se han realizado con el fin de inmovilizar bacterias lácticas en diferentes soportes desde los años 80 y los trabajos de revisión realizados hasta la fecha [9-11]. Ejemplo de estos ensayos son los trabajos de Rossi y Clementi [12], que estudiaron el catabolismo del ácido málico de O. oeni inmovilizado en gel de poliacrilamida. En este caso, las propiedades de las células inmovilizadas eran similares a las de las células libres pero el cultivo inmovilizado era más fácil de recuperar y volver a utilizar. Otros materiales de inmovilización para O. oeni con mejores perspectivas para su utilización a nivel industrial estudiados fueron k-carregan [13-14] y gel de alginato cálcico [15]. Más tarde se trabajó con poliacrilamida, silicagel, quitosan y virutas de madera para la inmovilización de Lactobacillus con resultados satisfactorios [16-17]. La inmovilización de L. casei en gel de Ca-pectato y quitosan modificado químicamente para la realización de la FML en vino, mostró que la tasa de degradación de ácido málico por parte de las células inmovilizadas fue dos veces superior al de las células libres. Maicas et al. [18] estudiaron la posibilidad de emplear células de O. oeni inmovilizadas en una esponja de celulosa cargada positivamente para la realización de la FML en vino. Los efectos de la carga de la superficie del material de inmovilización, el pH y la composición de medio fueron evaluados, lográndose tasas de degradación del ácido málico 3-4 veces mayores que con células libres. Aougurdis et al. [19] inmovilizaron células de O. oeni en material celulósico deslignificado, además evaluaron su estabilidad en repetidas FML y la formación de productos volátiles en comparación con los resultados obtenidos al inmovilizar L. casei en un estudio anterior[20]. Los datos mostraron que el material celulósico era un buen soporte para la inmovilización de O. oeni. Se comprobó también su estabilidad con la repetición de once fermentaciones durante un mes y se observó la formación de productos volátiles en concentraciones aceptables.
Recientemente se han realizado ensayos utilizando la combinación de diferentes materiales para la inmovilización. Ejemplo de ello, son los trabajos de Callone et al. [21] quienes estudiaron la inmovilización de levaduras y bacterias en microesferas de alginato cubiertas de una capa de sílice. Esta capa de sílice se obtuvo por tres metodologías diferentes con el objetivo de estudiar las diferencias en el intercambio de masa a través de esta capa y el mantenimiento de la viabilidad de las células. Los resultados confirmaron la eficacia de la inmovilización de las células en esta matriz de doble capa y que el recubrimiento de sílice mejoraba la estabilidad mecánica y reducía la fuga de células.
La biotecnología sigue aportando nuevas herramientas para abordar las actuales condiciones de vinificación. Como muestra la literatura, existen distintas posibilidades para facilitar la FML en bodega, mejorando la implantación de la bacteria, la rapidez y efectividad del proceso, el perfil aromático del vino, la seguridad microbiológica y la facilidad de uso por parte del enólogo. No obstante, se debe seguir investigando y mejorando las distintas tecnologías y dirigir los esfuerzos hacia aquellas que permitan en definitiva la mejora del perfil aromático y gustativo del vino, asegurando la calidad del producto final.
Bibliografía
1. Kunkee, R.E., Some roles of malic acid in the malolactic fermentacion in winemaking. FEMS Microbiology Letters, 1991. 88: p. 55-71.
2. Lonvaud-Funel, A., Microbiology of the malolactic fermentation: Molecular aspects. FEMS Microbiology Letters, 1995. 126(3): p. 209-214.
3. Reguant, C., Olguín, N. , Bordas, M., Rozès, N. y Bordons, A., Nuevos retos para Oenococcus oeni como consecuencia del cambio climático ACE. Ciencia y Tecnología
4. Krieger, S., Palacios, A., Herreros, R., Romero, S., Suarez, C., Heras, J.M. Momento óptimo de la fermentación maloláctica en el vino blanco.
5. Jussier, D., A. Dubé Morneau, and R. Mira de Orduña, Effect of Simultaneous Inoculation with Yeast and Bacteria on Fermentation Kinetics and Key Wine Parameters of Cool-Climate Chardonnay. Appl. Environ. Microbiol., 2006. 72(1): p. 221-227.
6. Nehme, N., F. Mathieu, and P. Taillandier, Impact of the co-culture of Saccharomyces cerevisiae-Oenococcus oeni on malolactic fermentation and partial characterization of a yeast-derived inhibitory peptidic fraction. Food Microbiology, 2009. 27(1): p. 150-157.
7. López, R., Garijo, P., Gutiérrez, A.R., Tenorio, C., López, I., Santamaría, P., Experiencias de inoculación de bacterias lácticas en distintos momentos de la elaboración de vinos tintos de Rioja (España), OIV, Editor. 2007.
8. Masqué, M.C., Romero, S.V., Rico,S. Elórduy, X. Puig, A., Capdevila, F., Suarez, C., Heras, J.M., Palacios, A.T., Coinoculación de levaduras y bacterias lácticas para la mejora organoléptica de los vinos y la reducción de la producción de aminas biógenas durante la fermentación maloláctica., in International Symposium Microbiology and Food Safety of Wine. 2007: Vilafranca del Penedés (Spain).
9. Y. Kourkoutas, A.B., I.M. Banat, R. Marchant, A.A. Koutinas, Immobilization technologies and support materials suitable in alcohol beverages production: a review. Food Microbiology, 2004. 21: p. 377-397.
10. Maicas, S., The use of alternative technologies to develop malolactic fermentation in wine. Applied Microbiology and Biotechnology, 2001. 56(1-2): p. 35-39.
11. Divies, C., J.F. Cavin, and H. Prevost, Bactéries lactiques immobilisées. In: Bactéries lactiques (II) Roissart & Luquet., (1994).
12. Rossi, J. and F. Clementi, L-malic acid catabolism by polyacrylamide gel entrapped Leuconostoc oenos. Am. J. Enol. Vitic., (1984). 35:: p. 100-102.
13. McCORD, J.D. and D.D.Y. RYU, Development of malolactic fermentation process using inmobilized whole cells and enzymes. Am. J. Enol. Vitic. 36: 214-218., (1985).
14. Crapisi, A., et al., Improved stability of immobilized Lactobacillus spp. cells for the control of malolactic fermentation in wine. Am. J. Enol. Vitic. 38: 310-312., (1987).
15. Spettoli, P., et al., Immobilization of Leuconostoc Oenos ml 34 in Calcium Alginate Gels and its Application to Wine Technology. Am. J. Enol. Vitic., 1982. 33(1): p. 1-5.
16. Kosseva, M., et al., Malolactic fermentation in chardonnay wine by immobilised Lactobacillus casei cells. Process Biochemistry, 1998. 33(8): p. 793-797.
17. NAOURI, P., et al., A new technology of malolactic bioconversion in wine. J. Wine Res., (1991). 2:: p. 5-20.
18. Maicas, S., I. Pardo, and S. Ferrer, The potential of positively-charged cellulose sponge for malolactic fermentation of wine, using Oenococcus oeni. Enzyme and Microbial Technology, 2001. 28(4-5): p. 415-419.
19. Agouridis, N., et al., Oenococcus oeni cells immobilized on delignified cellulosic material for malolactic fermentation of wine. Bioresource Technology, 2008. In Press, Corrected Proof.
20. Agouridis, N., et al., Malolactic Fermentation in Wine with Lactobacillus casei Cells Immobilized on Delignified Cellulosic Material. Journal of Agricultural and Food Chemistry, 2005. 53(7): p. 2546-2551.
21. Callone, E., et al., Immobilization of yeast and bacteria cells in alginate microbeads coated with silica membranes: procedures, physico-chemical features and bioactivity. Journal of Materials Chemistry, 2008. 18(40): p. 4839-4848.





