El dióxido de sulfuro (SO2) es el único componente, a excepción del alcohol, que merece una alerta en las etiquetas de los vinos, aunque, en algunos países, ciertas proteínas clarificantes que pueden estar presentes en el vino se encuentran en revisión regulatoria como alérgenos. El SO2 tiene diversas funciones de utilidad en la vinificación. Puede servir como inhibidor enzimático en mostos, para evitar la oxidación y la coloración marrón, como agente de control microbiológico en mostos y vinos, y para evitar la oxidación en los vinos acabados.1 También tiene la capacidad de unirse a compuestos volátiles no deseados, como el acetaldehído, reduciendo así su impacto sensorial.
Por desgracia, el SO2 también es un compuesto irritante y puede tener efectos negativos para la salud en consumidores sensibles. Se estima que cerca de un 1% de la población presenta una sensibilidad elevada a los sulfitos,2 otros estudios sugieren que el 5% de los asmáticos pueden tener reacciones adversas después de ingerir SO2.3-4 Sin embargo, se puede argumentar que, teniendo en cuenta su utilización tradicional en numerosos alimentos, hay pocos datos disponibles de su efecto sobre la salud.
Nuestro laboratorio estudia desde el año 2000 el metabolismo microbiano de los compuestos carbonilo para controlar y reducir el uso de SO2.5-12En este artículo, revisamos los resultados y la información de interés para los elaboradores que quieren minimizar la producción de estos compuestos que se unen al SO2también los niveles finales de SO2.
Límites legales de SO2 y percepción de los consumidores
La importancia que ha tenido el SO2 podría radicar en las connotaciones negativas asociadas con su uso, a pesar de tener un gran historial de utilización como conservante en numerosos alimentos y ser perfectamente seguro para la mayoría de consumidores. El destacable aumento de bodegas orgánicas y de vinos sostenibles o «frescos» que tienen menor concentración de SO2 puede indicar también que hay un creciente interés del consumidor por los vinos mínimamente procesados.
¿Cual es la comparación entre los límites de SO2 en los diferentes países? La Unión Europea (UE) ha reducido aún más el límite de SO2 total en vinos tintos y blancos hasta 150 y 200 mg/L, respectivamente (CE 606/2009, Anexo I B). Sin embargo, estos límites solo se aplican a vinos secos (<5 g/L de glucosa y fructosa combinados). Esta regulación incluye cuatro páginas más con exenciones, llegando a permitirse hasta 400 mg/L de SO2total en algunos vinos –cantidad superior al máximo de 350 mg/L que permite la regulación de Estados Unidos [27 CFR 4.22(b)(1)]–. De los países analizados, los niveles más bajos corresponden a Sudáfrica (tabla 1).
Tabla 1 Límites legales del SO2 total en los principales países productores (en mg/L)1
|
País / Zona |
Tipo de vino, azúcar residual |
Límite |
Referencia / Descripción legal |
|
EEUU
|
Todos |
350 |
27 CFR 4.22(b)(1) |
|
Australia
|
<35 g/L azúcares |
250 |
ANZFSC 4.5.1: Cláusula 5(5)(a) |
|
>35 g/L azúcares |
300 |
|
|
|
EEUU
|
<35 g/L azúcares |
2502 |
|
|
>35 g/L azúcares |
4002 |
|
|
|
Unión Europea
|
Blanco / rosado, < 5 g/L
|
200
|
CE Nº 606/2009, Anexo I B
|
|
Tinto, < 5 g/L azúcares
|
150
|
||
|
Blanc / rosat > 5 g/L
|
250
|
||
|
Tinto > 5 g/L azúcares
|
200
|
||
|
Vinos específicos
|
300
|
Por ej., Spätlese (puede ser seco), Burdeos, Costas de Burdeos, C. de Bergerac, Navarra, Penedès, diversos vinos de país franceses y húngaros, y algunos dulces de Grecia | |
|
Vinos específicos
|
350
|
Por ej.: Auslese (puede ser seco), vinos dulces de Rumanía, República Checa, Eslovaquia y Eslovenia | |
|
Vinos específicos
|
400
|
Per ej. : Beerenauslese, TBA Eiswein, vinos dulces fraceses como sauternes, barsac, etc., dulces griegos con > 45 g/L de azúcares, dulces de Europa del Este | |
|
Canadá
|
Todos
|
3503
|
Canadian Food & Drug Reg. B.02.100 |
|
India
|
Todos
|
450
|
Acta y reglas de prevención del adulteramiento de alimentos, Apéndice C, Tabla 3 |
|
Japón
|
Todos (>1%)
|
3502
|
Especificaciones y estándares japoneses para aditivos alimentarios |
|
Rusia
|
Blanco, < 5 g/L azúcares
|
160
|
Regulaciones de Productos licorosos Acta 60 de 1989 Regulación 32 (Tabla 8) |
|
Tinto, < 5 g/L azúcares
|
150
|
||
|
Todos, > 5 g/L azúcares
|
200
|
||
|
Vinos específicos
|
300
|
Per ej.: nobles de vendimias tardías y secados naturalmente |
1 Información obtenida de la base de datos FIVS-Abridge (www.fivs-abridge.com)
2 La unidad es mg/kg.
3 Canadá prescribe un máximo de 70 mg/L de SO2 libre, o 350 mg/L combinado.
Efectivamente, es de poca utilidad comparar los niveles de SO2 entre regiones climáticas muy diferentes. En los climas fríos el vino puede necesitar un poco de azúcar residual para equilibrar. También, los veranos húmedos, momento en que crece el racimo, y unas condiciones meteorológicas adversas durante la vendimia pueden otorgar una carga adicional de SO2. Por ejemplo, en el este de Francia y Alemania, la vendimia de 2006 se caracterizó por racimos con un alto grado de podridura. En los vinos finales, los niveles de SO2 ligado (especialmente por el ácido pirúvico y el acetaldehído) eran significativos y, en consecuencia, Alemania y Alsacia solicitaron un aumento de 40 mg/L en el máximo total de SO2 para esta vendimia en particular, lo que les fue concedido [CE 423/2008 Artículo 23(4) y Anexo XV], de la misma manera que se hizo en el año 2000.
Compuestos de unión a SO2, ocurrencia en vinos y análisis
Para una cantidad dada de SO2 libre, las concentraciones finales de SO2 dependerán de la concentración de sus moléculas de unión. Compuestos con funciones carbonilo se unen al SO2 . Entre los principales compuestos de unión a sulfuro que se encuentran en el vino está la glucosa, la acetoína, el diacetil y los ácidos galacturónico, alfa-cetoglutárico y pirúvico, y especialmente el acetaldehído. Hay disponibles numerosos métodos de cuantificación en el vino de compuestos de unión al SO2.13-17 Los análisis individuales resultan rutinarios y tediosos. En nuestro laboratorio determinamos simultáneamente los principales compuestos de unión a SO2 utilizando cromatografía líquida de alta resolución (HPLC). Sin embargo, también es posible determinar los principales agentes de unión a SO2 –el acetaldehído y los ácidos pirúvico y alfa-cetoglutárico– con pruebas enzimáticas relativamente económicas utilizando un espectrofotómetro estándar.
En los últimos años hemos analizado numerosos vinos para encontrar los principales compuestos ligados a SO2. En los vinos tintos, los ácidos galacturónico y alfa-cetoglutárico aparecían en mayor concentración que en los blancos. En cambio, los vinos blancos contenían más pirúvico y acetaldehído que los tintos (tabla 2).
Tabla 2 Concentraciones promedio (mg/L) de diversos compuestos de unión a SO2 en vinos blancos y tintos del Estado de Nueva York*
|
Tipo de vino |
Glucosa |
Ácido |
Alfa-cetoglutarato |
Piruvato | Acetoïna | Acetaldehído |
|
Blanco
|
4750 |
267 |
31 |
25
|
10
|
40
|
|
Tinto
|
1400 |
810 |
74 |
14
|
11
|
25
|
* Se analizó un total de 237 vinos
Utilizando estos datos, podríamos deducir que los principales compuestos de unión a SO2 eran el acetaldehído y los ácidos pirúvico, alfa-cetoglutárico y galacturónico, debido a sus propiedades de unión y sus concentraciones en el vino. En vinos blancos, el acetaldehído suele ser responsable del 70% del SO2unido, seguido por el pirúvico (17%) y el alfa-cetoglutárico (8%). En vinos tintos, se ha visto que el acetaldehído es responsable de más del 50% del SO2 unido, seguido por el alfa-cetoglutárico (>20%), el pirúvico (12%) y el galacturónico (10%). En vinos dulces, la glucosa puede ser también relevante en la unión a SO2.
Dada la importancia del SO2 unido, la formación y degradación de acetaldehído es particularmente relevante.
El acetaldehído en los vinos: papel, formación y degradación
El acetaldehído es el más importante de los carbonilos volátiles en el vino y se puede formar tanto biológicamente (por la actividad de las levaduras) como química (por oxidación del vino). Es una molécula pequeña y extremadamente reactiva, que produce aromas de hierba, manzana o nueces.
Formación
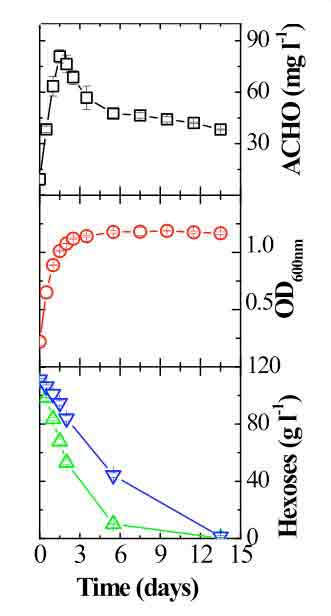
Es común pensar, equivocadamente, que el riesgo de formación de acetaldehído comienza solo al final de la fermentación alcohólica. Sin embargo, en gran medida, el acetaldehído de los vinos proviene de la actividad de las levaduras. Las levaduras enológicas, incluidas las cepas comerciales de Saccharomyces cerevisiae, excretan este compuesto durante las fases iniciales de la fermentación alcohólica.10,11,18Después de alcanzar un valor máximo, parte del acetaldehído se reutiliza (fig. 1). Los residuos de acetaldehído encontrados en gewürztraminer y riesling después de la fermentación alcohólica oscilan generalmente entre 22 y 49 mg/L.11
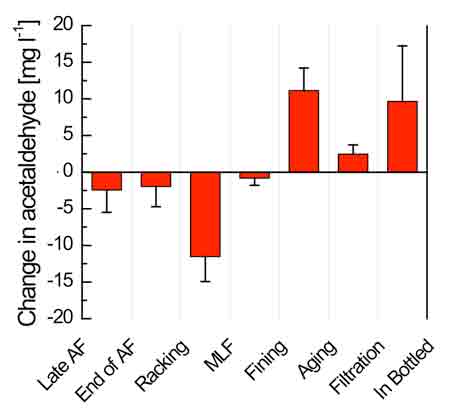
La formación química de acetaldehído se basa en la exposición al oxígeno, la presencia de metales de transición como el cobre y el hierro, y en los fenoles.20 De hecho, si se exponen los vinos al oxígeno atmosférico después de la fermentación alcohólica y maloláctica, y se eliminan las lías de las levaduras, se pueden formar cantidades significativas de acetaldehído por oxidación del etanol. La figura 2 muestra las variaciones medias en la concentración de acetaldehído durante la vinificación de 16 vinos en ocho bodegas durante la vendimia de 2009. Las operaciones de envejecimiento posfermentativo, desfangado, trasvase, filtrado y embotellado favorecieron a aumentar el acetaldehído.
Degradación
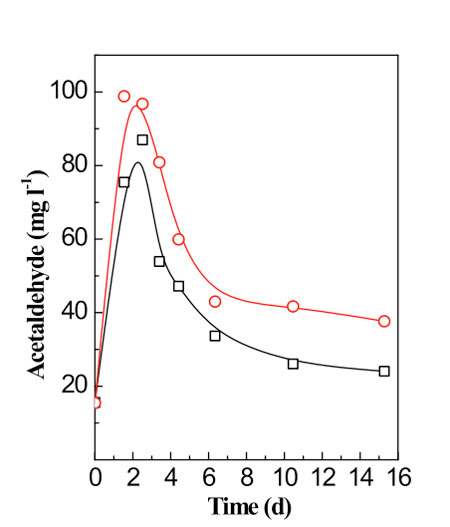
Además de la reutilización parcial del acetaldehído por las levaduras durante la segunda mitad de la fermentación alcohólica (fig. 1), este también es degradado por bacterias de ácido láctico.7-9 Normalmente, el acetaldehído desaparece durante la fermentación maloláctica, ya sea al mismo tiempo que se degrada el ácido L-málico, o algunos días después (fig. 3).
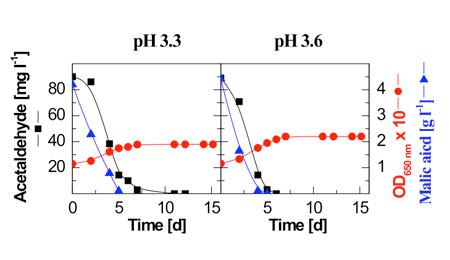
Por consiguiente, si se desea una degradación completa del acetaldehído, no se han de estabilizar los vinos hasta pasados cinco días de la desaparición del ácido málico: Y todavía más importante, se ha visto que la fermentación maloláctica causa una reducción sustancial del ácido pirúvico y la reducción parcial de alfa-cetoglutárico (tabla 3). Por tanto, la fermentación maloláctica ofrece una contribución muy significativa de cara a conseguir reducir los niveles de SO2 unido y total.
Tabla 3 Porcentaje de degradación de los compuestos de unión a SO2 por 12 cepas de bacterias vínicas de ácido láctico (Oenococcus oeni) durante la fermentación maloláctica (valores medios representados)
|
Compuestos de unión SO2
|
% degradación |
|
Acetaldehído
|
94 |
|
Piruvato
|
87 |
|
Alfa-cetoglutarato
|
73 |
|
Acetoína
|
20 |
|
Ácido galacturónico
|
0
|
Principales factores que influyen en los residuos de acetaldehído en los vinos
Tanto los factores biológicos como los químicos son importantes para los niveles de acetaldehído en vinos.
Factores biológicos
Los residuos de acetaldehído serán mayores si: 1) la formación inicial es elevada y/o si 2) se reduce su reutilización. Un factor que afecta a la formación inicial es la cepa de la levadura. Las cepas de S. cerevisiae que predominan en la fermentación alcohólica, independientemente de si han estado o no inoculadas, tienden a producir más acetaldehído que la mayoría de levaduras que no son de la especie S. cerevisiae, con algunas excepciones: por ejemplo, se ha identificado una cepa de Schizosaccharomyces pombe que excreta grandes cantidades. La excreción de acetaldehído y su reutilización no es idéntica en todas las cepas de S. cerevisiae, aunque es bastante uniforme comparada con las otras especies.10
Sin embargo, el factor más importante para la formación biológica de acetaldehído es la adición de SO2 en los mostos (fig. 4). Las levaduras producen más acetaldehído como respuesta a esta práctica. Revisando diversos trabajos con más de una veintena de cepas de levaduras diferentes, hemos encontrado que la adición de 1 mg/L de SO2 aumenta el residuo final de acetaldehído que queda después de la fermentación alcohólica de 0,2 a 0,5 mg/L. Por lo tanto, la adición al mosto de 50 mg/L de SO2 aumentará los niveles finales de acetaldehído en unos 10 a 25 mg/L y, por tanto, incrementará los niveles de SO2 unido de unos 15 a 37 mg/L.10
Se ha visto que la reutilización de acetaldehído por las levaduras en las últimas fases de la fermentación alcohólica mejora mediante factores que también mantienen un gran número de levaduras viables en el cultivo. En consecuencia, añadir nutrientes para las levaduras y mantener la temperatura moderada (20 ºC) conducía a reducir los residuos de acetaldehído, mientras que mantener la temperatura elevada (12 ºC) durante las fermentaciones y no añadir nutrientes daba lugar a mayores residuos.11 Desfangar las lías de las levaduras al inicio reduce también la reutilización del acetaldehído y da lugar a niveles más elevados de SO2 ligado.11
El potencial de la fermentación maloláctica para reducir el acetaldehído y otros compuestos de unión a SO2 es significativo. Sin embargo, la fermentación maloláctica puede ser difícil de conseguir en algunos vinos, especialmente en los que más se beneficiarían. Entre los factores que inhiben las bacterias malolácticas, el alcohol y las concentraciones de SO2 libre son cruciales, así como la temperatura, el pH y la disponibilidad de nutrientes. Menos atención se ha prestado a los niveles de SO2 ligado. Resultados recientes de nuestro grupo muestran claramente que las bacterias malolácticas están inhibidas por el SO2 ligado al acetaldehído (hidroxisulfonado de acetaldehído), incluso en completa ausencia de SO2 libre (tabla 4).
Esta observación es crítica desde una perspectiva de elaboración de vino interesada en reducir el SO2. Grandes adiciones de SO2 en el mosto darán lugar, después de la fermentación alcohólica, a niveles finales de SO2 ligado elevados. Estos elaboradores tendrán que evitar reducciones adicionales de los compuestos de unión a SO2 por fermentación maloláctica.
Tabla 4 Duración de la fase estacionaria y pérdida del SO2 ligado a acetaldehído y del ácido málico durante la fermentación maloláctica por una cepa comercial de Oenococcus oeni en presencia de diferentes concentraciones de SO2 ligado
|
Concentración de SO2 ligado a acetaldehído [mg L1] |
||||
|
0 |
30 | 60 | 90 | |
|
Parámetro
|
Duración de la fase de latencia e intervalo de desaparición del ácido málico y el acetaldehído [días] |
|||
|
Fase de latencia
|
0 |
8,2 | 12,8 | 18,7 |
|
Eliminación del ácido málico
|
3,5 |
10,6 | 14,9 | 27 |
|
Eliminación del SO2 ligado
|
0
|
10,4 | 27 | 30,8 |
Actualmente, la fermentación maloláctica sigue siendo la herramienta particular más relevante para reducir las concentraciones de SO2 unido en los vinos. En un futuro puede haber nuevos métodos para reducir los compuestos de unión a SO2. Unos investigadores de Burdeos han patentado un método que permitiría la reducción de carbonilos de unión a SO2 en los vinos mediante una resina insoluble. El método se pensó específicamente para sauternes, que suelen sufrir de grandes concentraciones de compuestos de unión a SO2. Hasta ahora, no se ha hecho una valoración del método por parte de la comunidad científica, y no se permite su uso.21-23
Puntos principales
|
Agradecimientos
Estos proyectos están financiados por la New York Wine and Grape Foundation, Nolan and Canandaigua Wine Co. Endowment Funds, los fondos USDA Federal Formula, Lallemand Inc,. Y el China Scholarship Council (State Scholarship Fund No. 2008630061).
Bibliografía
1. Boulton, R. B., Singleton, V. L., Bisson, L. F. and Kunkee, R. E. Principles and Practices of Winemaking . Chapman & Hall , New York , 1996.
2. Papazian, R. Sulfites: safe for most, dangerous for some. FDA Consumer Magazine 1996; 30: 10-5.
3. Snelten, H. J. and Schaafsma, G. Health aspects of oral sulphite, and sulphite in wine. Voeding 1992; 53: 88-90.
4. Vally, H., Carr, A., El Saleh, J. and Thompson, P. Wine-induced asthma: A placebo-controlled assessment of its pathogenesis. Journal of Allergy and Clinical Immunology 1999; 103: 41-6.
5. Mira de Orduña, R., Osborne, J. P., Pickering , G. J., Liu, S.-Q. and Pilone, G. J. (2002) Acetaldehyde metabolism in malolactic bacteria and its effect on bacterial growth. In: Les Entretiens Scientifiques Lallemand: Proceedings of the International Lallemand Expert Symposium, pp. 33-38. Perugia, Umbria, Italy .
6. Dubé Morneau, A. and Mira de Orduña, R. Acetaldehyde in wines: analysis, occurrence and removal by wine lactic acid bacteria. p. 105. Intervitis, Stuttgart , Germany , 2007.
7. Osborne, J. P., Mira de Orduña, R., Liu, S.-Q. and Pilone, G. J. Acetaldehyde metabolism by wine lactic acid bacteria. FEMS Microbiol Lett 2000; 191: 51-5.
8. Jussier, D., Dubé Morneau, A. and Mira de Orduña, R. Effect of simultaneous inoculation of yeast and bacteria on fermentation kinetics and key wine parameters during white winemaking. Appl Environ Microbiol 2006; 72: 221-7.
9. Osborne, J. P., Dubé Morneau, A. and Mira de Orduña, R. (2006) Degradation of free and sulphur-dioxide-bound acetaldehyde by malolactic lactic acid bacteria in white wine. J Appl Microbiol 2006; 101: 474-9.
10. Li, E. and Mira de Orduña, R. (2010) Evaluation of the acetaldehyde production and degradation potential of 26 enological Saccharomyces and non- Saccharomyces yeast strains in a resting cell model system. Journal of Industrial Microbiology and Biotechnology 2010 (16 Dec): 1-8. doi:10.1007/s10295-010-0924-1.
11. Jackowetz, J. N., Dierschke, S. E. and Mira de Orduña, R. Multifactorial analysis of acetaldehyde kinetics during alcoholic fermentation by Saccharomyces cerevisiae . Food Res Int 2011; 44: 310-6.
12. Pan, W., Jussier, D., Terrade, N., Yada, R. Y. and Mira de Orduña, R. (2011) Kinetics of sugars, organic acids and acetaldehyde during simultaneous yeast-bacterial fermentations of white wine at different pH values. Food Res Int 2011; 44: 660-6.
13. Lea, A. G. H., Ford, G. D. and Fowler, S. Analytical techniques for the estimation of sulphite binding components in ciders and wines. Int J Food Sci Technol 2000; 35: 105-12.
14. Elias, R. J., Laurie, V. F., Ebeler, S. E., Wong, J. W. and Waterhouse, A. L. Analysis of selected carbonyl oxidation products in wine by liquid chromatography with diode array detection. Anal Chim Acta 2008; 626: 104-10.
15. Matsuura, H., Fujiyama , K., Minagawa, N. and Sawa, J. Determination of acetoin, diacetyl and acetaldehyde in foods by HPLC. Bunseki Kagaku 1990; 39: 405-9.
16. Azevedo, L. C. de, Reis, M. M., Pereira, G. E., Rocha, G. O. da, Silva, L. A. and de Andrade, J. B. A liquid chromatographic method optimization for the assessment of low and high molar mass carbonyl compounds in wines. J Sep Sci 2009; 32: 3432-40.
17. Schmidt, R. H., Davidson, S. M. and Bates, R. P. Acetaldehyde determination in fermented food-products by direct 2,4-dinitrophenylhydrazine derivatization, extraction and high-performance liquid-chromatography. J Food Sci 1983; 48: 1556-7.
18. Cheraiti, N., Guezenec, S. and Salmon, J. M. (2010) Very early acetaldehyde production by industrial Saccharomyces cerevisiae strains: a new intrinsic character. Appl Microbiol Biotechnol 2010; 86: 693-700.
19. Danilewicz, J. C. Interaction of sulfur dioxide, polyphenols, and oxygen in a wine-model system: Central role of iron and copper. Am J Enol Vitic 2007; 58: 53-60.
20. Danilewicz, J. C. Review of reaction mechanisms of oxygen and proposed intermediate reaction products in wine: central role of iron and copper. American Journal of Enology and Viticulture 2003; 54: 73-85.
21. Blasi, M., Barbe, J. C., Dubourdieu, D. and Deleuze, H. (2008) New method for reducing the binding power of sweet white wines. J Agric Food Chem 2008; 56: 8470-4.
22. Deleuze, H., Blasi, M., Barbe, J. C., Dubourdieu, D. and Maillard, B. Process for extracting carbonylated compounds from a drink by liquid-solid extraction with a functionalized inert support. WO 2007/107603 A1, 2007.
23. Deleuze, H., Blasi, M., Barbe, J. C., Dubourdieu, D. and Maillard, B. Extraction of carbonyl compounds from beverages using an inert solid support. Patent Number France-2898891, 2007.