La transformación de la uva en vino es un proceso biotecnológico en el que los microorganismos presentes, fundamentalmente las levaduras, utilizan los nutrientes del mosto para su crecimiento, produciendo una gama de metabolitos que convierten un líquido azucarado en una solución hidroalcohólica de sabor y aroma agradable.
El mosto de uva es un medio muy complejo, con una gran variedad de compuestos que van desde los mayoritarios (azúcares) hasta compuestos en cantidades muy pequeñas pero importantes, tanto desde el punto de vista nutricional (vitaminas, minerales) como organoléptico (aromas y precursores). No obstante, dista mucho de ser un medio de cultivo óptimo, ya que en realidad se convierte en un medio altamente selectivo.
Esta selectividad es consecuencia, por un lado, del elevado contenido en azúcares (presente en concentraciones equimolares de glucosa y fructosa que oscilan entre 170 y 280 g/L, aunque en determinados casos pueden llegar hasta concentraciones muy superiores: concentración por deshidratación, pasificación, ataques de hongos como Botrytis, algunas técnicas enológicas,…) y, por otro, del fuerte desequilibrio con la fracción nitrogenada, con concentraciones 3 órdenes de magnitud inferiores (concentraciones entre 70 y 600 mg/L). Este componente nitrogenado es utilizado por las levaduras para reproducirse (producción de biomasa) durante la fermentación alcohólica y asegurar un número de células suficientes para consumir todos los azúcares del mosto. Por lo tanto, el contenido en nitrógeno condiciona la realización de la fermentación alcohólica, tanto en su velocidad como en su culminación.1 Pero además, la mayoría de las fuentes nitrogenadas del mosto (amonio y aminoácidos) son a su vez precursores aromáticos, determinando igualmente la calidad aromática del vino.
El nitrógeno en el mosto puede estar presente en dos formas claramente diferenciadas: la inorgánica, básicamente como amonio, y la orgánica formada por aminoácidos, péptidos y proteínas. No todas estas formas son igualmente disponibles para la levadura ya que, por ejemplo, los péptidos y las proteínas no se suelen considerar como auténticas fuentes de nitrógeno, y los aminoácidos son muy variables como fuentes nitrogenadas ya que mientras algunos son consumidos ávidamente (glutamina, por ejemplo), otros no lo son en absoluto en condiciones anaerobias, como la prolina. Curiosamente la prolina, junto con la arginina, son los dos aminoácidos mayoritarios en mostos de uva.
El amonio suele ser altamente disponible para las levaduras, por lo que es una forma química que se suele utilizar de forma abundante en la industria enológica. La presencia de nitrógeno en cualquiera de estas formas químicas es fuertemente variable, dependiendo de diversos factores, entre ellos la variedad de uva, su grado de maduración, características edafoclimáticas y diversos aspectos tecnológicos (tipo de vinificación, prensado, etc.). No obstante, y como parte de una estrategia adaptativa a la fermentación del mosto, la levadura vínica Saccharomyces cerevisiae no consume este nitrógeno asimilable de manera aleatoria, sino que tiene un orden de preferencia por las distintas fuentes de nitrógeno. S. cerevisiae ha desarrollado diferentes mecanismos moleculares que le permiten utilizar preferentemente aquellas fuentes que mantienen un mejor crecimiento.
Este mecanismo de selección de la fuente de nitrógeno se conoce como represión catabólica por nitrógeno (NCR).2 La NCR se caracteriza porque la célula es capaz de detectar la presencia de las fuentes de nitrógeno ricas y desencadenar una cadena de señales, que culmina con la activación de los genes implicados en el transporte y metabolismo de estas fuentes ricas y en la represión de aquellos genes implicados en el transporte y utilización de fuentes más pobres. Una vez consumidas las fuentes de nitrógeno más ricas (amonio, glutamina y asparagina), la levadura activa la maquinaria metabólica para la utilización de las más pobres (arginina, glutamato, alanina, etc.).
En el actual contexto de cambio climático, la excesiva maduración de la uva tiene dos consecuencias muy directas en la composición del mosto: el aumento de los azúcares a fermentar y la disminución del contenido nitrogenado. Esto dificulta todavía más si cabe la tarea fermentativa de la levadura y hace muy necesario el conocimiento sobre las necesidades nitrogenadas de las diferentes levaduras vínicas utilizadas en la industria enológica.
En el año 2008 se inició un proyecto de investigación en Viticultura y Enología (CENIT-DEMETER) cuyo objetivo transversal era precisamente el efecto del cambio climático en el sector vitivinícola. Nuestros dos grupos de investigación (IATA y URV) han participado en dicho proyecto con un objetivo global: analizar las necesidades concretas de diferentes levaduras vínicas durante la fermentación alcohólica, así como las fuentes y concentración de nitrógeno más adecuadas para conseguir una buena velocidad fermentativa y una óptima calidad organoléptica de los vinos. A continuación se resumen algunos de los resultados más destacables.
Efecto de la concentración y tipo de nitrógeno sobre el crecimiento de las levaduras y su cinética fermentativa
Cuatro levaduras comerciales (PDM, RVA, TTA y ARM), todas ellas comercializadas por la empresa Agrovin, fueron crecidas en un mosto sintético con diferentes fuentes de nitrógeno (amonio, glutamina y arginina) y concentraciones (desde 5 hasta 300 mg N/L). A modo de resumen, en la figura 1 se muestra la tasa de crecimiento máxima (µmax = h-1) de cada cepa en función de la fuente y la concentración de nitrógeno.3Hemos observado que los efectos sobre el crecimiento celular dependen notablemente de la fuente de nitrógeno, la concentración de azúcar4 y de la cepa de levadura utilizados.3
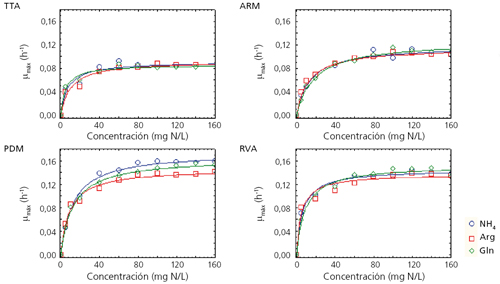
Se pudo observar que el aumento de biomasa es proporcional al aumento de concentración de nitrógeno hasta que llega a una concentración a partir de la cual ya no aumenta esta biomasa; es decir sería la concentración mínima de nitrógeno para obtener la biomasa máxima (Nitrogen Reference Value, NRV). Esta concentración varía en función de la concentración de azúcar, siendo para la cepa de referencia PDM de 140 mg N/L con 200 g de azúcar, de 160 mg N/L para 240 g de azúcar y de 180 mg N/L para 280 g de azúcar.4 A pesar de que la NRV es similar para las diferentes fuentes nitrogenadas, no lo es para las diferentes cepas de levaduras. Además, las demandas de nitrógeno son fuertemente dependientes de la cepa y esta dependencia se manifiesta en que las cepas con mayores demandas de nitrógeno presentan también una captación de nitrógeno más rápida acompañada asimismo de mayor crecimiento.3 En general, las formulaciones mixtas de fuentes nitrogenadas o aquellas en las que la fuente es mayoritariamente orgánica resultan en una mayor producción de biomasa.
Impacto de la fuente y concentración de nitrógeno durante la fase estacionaria en la fermentación alcohólica
En el desarrollo del proyecto hemos observado que el nitrógeno impacta en el metabolismo celular de dos maneras: aumentando el número de células de la población de levaduras y estimulando la tasa fermentativa en cada una de estas células, siendo en ocasiones difícil de distinguir ambos efectos. Una vez habíamos determinado la NRV para cada cepa, esa concentración asegura obtener el máximo poblacional. Sin embargo, la fermentación alcohólica es un proceso donde la mayor parte de los azúcares son consumidos en una fase de no proliferación celular o fase estacionaria. Por tanto, la pregunta era obvia: ¿tiene algún efecto sobre la velocidad fermentativa disponer de nitrógeno durante esta fase estacionaria? Para poder responder a dicha pregunta, se hacían crecer las células en un mosto completo con la concentración limitante de nitrógeno (NRV) determinado en el punto anterior. Cuando se había alcanzado la fase estacionaria y se había consumido la totalidad del nitrógeno, el medio de fermentación se separaba en diferentes fermentaciones a las que se añadían distintas concentraciones de nitrógeno en forma de amonio o arginina.
Los resultados de este trabajo mostraban que la disponibilidad de nitrógeno en la fase estacionaria suponía un estímulo de la tasa de fermentación y una finalización más rápida de los azúcares fermentables. Obviamente, las concentraciones de nitrógeno necesitadas son mucho más bajas (aproximadamente, y dependiendo de la cepa, unos 40 mg N/L) que las necesitadas para asegurar el máximo poblacional (NRV). Además, lo que resulta más interesante, la disponibilidad de nitrógeno durante esta fase de no proliferación celular tiene un impacto muy determinante sobre la síntesis de aromas. A modo de ejemplo, la figura 2 muestra un análisis de componentes principales (PCA), donde se observa que la mayor síntesis de ésteres de acetato y de etilo se sitúa en la zona donde las células disponían de una mayor concentración de nitrógeno (especialmente de arginina).
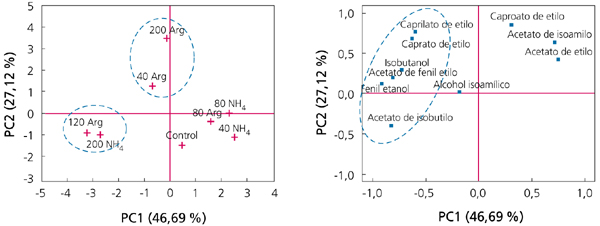
La mayor síntesis de compuestos aromáticos probablemente se relaciona con un mayor consumo de nitrógeno, ya que actúan como precursores de la síntesis de ésteres y regulan su producción.5 Sobre la base de los resultados de estos trabajos, es importante que las células de levaduras dispongan de suficiente nitrógeno para producir la máxima población de células activas durante la fase exponencial de crecimiento. Sin embargo, para mantener una buena vitalidad fermentativa durante la fase estacionaria, es interesante la disponibilidad de nitrógeno durante esta fase, especialmente en forma de nitrógeno orgánico (arginina), que aseguren una finalización correcta de la fermentación y un perfil aromático correcto.
No obstante, la adquisición de la biomasa máxima no asegura la finalización de la fermentación. De hecho, a concentraciones de 280 g azúcar/L en las condiciones de mostos sintéticos, concentraciones de nitrógeno de 180 mg N/L (NRV para PDM) y 300 mg N/L presentaron paradas de fermentación, si bien la parada se produjo con diferentes concentraciones de azúcares residuales, dependiendo de la fuente nitrogenada utilizada.4
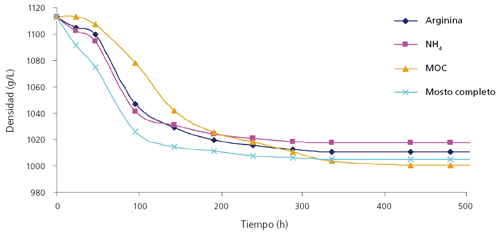
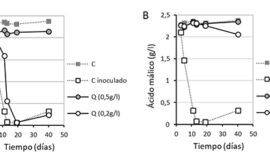
En este caso, las fuentes orgánicas de nitrógeno, especialmente las más complejas (una mezcla de leucina, isoleucina, valina, fenilalanina y treonina, abreviado como MOC) produjeron un mayor consumo de azúcares que las otras condiciones (fig. 3). Asimismo, las células en estas condiciones mantenían una mayor vitalidad, medida por la capacidad de alteración de la impedancia del medio.
Efecto de las adiciones de nitrógeno en fermentaciones industriales
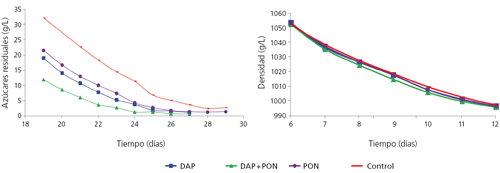
Con estos resultados y anteriores observaciones de nuestro grupo6 sobre adición de nitrógeno en diferentes fases de la fermentación, propusimos a las bodegas colaboradoras en el Proyecto CENIT DEMETER una adición de compuestos nitrogenados a mitad de fermentación. La propuesta era utilizar mostos pobres en nitrógeno y altos en azúcar y añadir nitrógeno inorgánico al inicio, si no se llegaba a un mínimo de nitrógeno (por debajo del NRV). Después, en todos los casos, se añadieron a mitad de fermentación (densidad entre 1050 y 1060 g/L) diferentes combinaciones de nitrógeno orgánico y/o inorgánico. Observamos que, en todos los mostos que presentaban una concentración elevada de nitrógeno (250-300 mg N/L), no se producía ningún efecto sobre la cinética fermentativa, mientras que en aquellos que las concentraciones estaban próximas a los valores de referencia, se producía una mejora con cualquier adición de nitrógeno (fig. 4). No obstante, a nivel sensorial, el efecto destacable era que aquellos mostos pobres, a los que se había añadido nitrógeno orgánico (PON, preparado orgánico de nitrógeno de Agrovin), presentaban una mayor complejidad aromática, generalmente asociada al descriptor aromático floral. En estos casos, el nitrógeno residual presente en los vinos era igual a los mostos a los que no se le había realizado la adición nitrogenada, mientras que los mostos ricos en nitrógeno no presentaban diferencias sensoriales.
Marcadores para la detección de deficiencias de nitrógeno durante la fermentación alcohólica en diferentes levaduras vínicas comerciales
Otro objetivo de este proyecto era el análisis y puesta a punto de diferentes marcadores moleculares y bioquímicos para la detección precoz de carencias nutricionales en las células de levaduras durante la fermentación alcohólica. En concreto, se han ensayado dos marcadores bioquímicos (la acumulación de trehalosa y la actividad del enzima arginasa) y varios marcadores moleculares basados en la actividad de varios genes, cuya expresión viene determinada por la concentración de nitrógeno del medio. Finalmente, hemos refinado y simplificado el sistema mediante la utilización de un reporter o chivato de la carencia de nitrógeno basado en la síntesis de la proteína fluorescente verde (GFP).7
A modo de resumen mencionar que la acumulación intracelular de trehalosa estaba más marcada por la entrada en fase estacionaria de las células que por la concentración de nitrógeno en el medio. Al contrario de lo esperado, esta acumulación era mayor cuanto mayor era la concentración de nitrógeno. La arginasa sí que mostraba una activación en todas las cepas inversamente proporcional a la concentración de nitrógeno del medio, por lo que se puede considerar un marcador útil para determinar carencia de nitrógeno por parte de la célula. Igualmente buena era la respuesta transcripcional de los genes GAP1 y DAL4, seleccionados como marcadores moleculares. Sin embargo, tanto la determinación de la actividad arginasa como la actividad transcripcional de estos genes es complicada como técnica rutinaria de análisis, por lo que se decidió simplificar mediante la introducción del gen de la GFP bajo el control de los promotores de los mencionados genes. Como la transcripción o actividad del gen depende del promotor, podríamos monitorizar, prácticamente on-line, la actividad de este gen mediante la fluorescencia emitida por las células. A modo de ejemplo, en la figura 5 se muestra cómo la fluorescencia total o el porcentaje de células fluorescentes era inversamente proporcional a la concentración del nitrógeno del mosto.
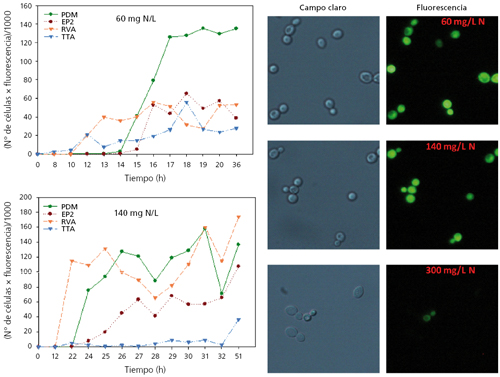
En esta misma figura se puede ver la monitorización de dos fermentaciones con distinta concentración de N (60 y 140 mg N/L) y comprobar el momento exacto en que se produce un aumento de la fluorescencia, y por tanto, de necesidad nutricional de la cepa (fig. 5). La determinación del momento exacto en que las células de levadura detectan carencia de nitrógeno tiene un gran interés industrial porque permite saber al enólogo el momento de la fermentación más conveniente para la suplementación con nitrógeno adicional.
Bibliografía
1. Thaillandier P., Ramon-Portugal F., Fuster A., Strehaiano P. Effect of ammonium concentration on alcoholic fermentation kinetics by wine yeasts for high sugar content. Food Microbiology 2007; 24: 95-100.
2. Cooper T.G. Transmitting the signal of excess nitrogen in Saccharomyces cerevisiae from the Tor proteins to the GATA factors: connecting the dots. FEMS Microbiol Rev 2006; 26: 223-8.
3. Gutiérrez A., Chiva R., Sancho M., Beltran G., Arroyo-López F.N., Guillamón J.M. Nitrogen requirements of commercial wine yeast strains during fermentation of a synthetic grape must. Food Microbiology 2012; 31: 25-32.
4. Martínez-Moreno R., Morales P., González R., Mas A., Beltran G. Biomass Production and alcoholic fermentation performance of Saccharomyces cerevisiae as a function of nitrogen source. FEMS Yeast Research2012; 12: 477-82.
5. Swiegers J.H., Pretorius I.S. Yeast modulation of wine flavor. Advances in Applied Microbiology 2005; 57: 131-75.
6. Beltran G., Esteve-Zarzoso B., Rozes N., Mas A., Guillamón J.M. Influence of the timing of nitrogen additions during synthetic grape must fermentations on fermentation kinetics and nitrogen consumption. J Agric Food Chem 2005; 53: 996-1002.
7. Gutiérrez A., Chiva R., Beltran G., Mas A., Guillamón J.M. Biomarkers for detecting nitrogen deficiency during alcoholic fermentation in different commercial wine yeast strains. Food Microbiology 2013; 34: 227-37.