Introducción
 El mildiu es una de las enfermedades de vid más destructivas a nivel mundial y está causado por el oomycete Plasmopara viticola (Berk. And Curt.) Berl. y de Toni. Su control está basado en la aplicación de fungicidas a base de cobre. Se requiere una elevada inversión en fitosanitarios cada año y en mano de obra especializada, así como una vigilancia muy estricta para no aplicar más tratamientos de los que son absolutamente necesarios. Todas las viníferas (Vitis vinifera L.) son susceptibles a esta enfermedad, aunque el nivel de sensibilidad cambia de unas variedades a otras, tal y como ya se ha observado en estudios previos (Boso et al., 2011, 2014).
El mildiu es una de las enfermedades de vid más destructivas a nivel mundial y está causado por el oomycete Plasmopara viticola (Berk. And Curt.) Berl. y de Toni. Su control está basado en la aplicación de fungicidas a base de cobre. Se requiere una elevada inversión en fitosanitarios cada año y en mano de obra especializada, así como una vigilancia muy estricta para no aplicar más tratamientos de los que son absolutamente necesarios. Todas las viníferas (Vitis vinifera L.) son susceptibles a esta enfermedad, aunque el nivel de sensibilidad cambia de unas variedades a otras, tal y como ya se ha observado en estudios previos (Boso et al., 2011, 2014).
No se conoce con exactitud el número de viníferas que existen, pues los datos varían dependiendo de la bibliografía consultada. Los últimos trabajos publicados apuntan a unos 6000 genotipos diferentes (Lacombe, 2012). Solo un pequeño número de todas las existentes (entre 10-12 variedades) son utilizadas actualmente en grandes extensiones para la elaboración de vinos. La fuerte competencia en los mercados vitivinícolas ha hecho que en los últimos veinte años se despierte el interés por la recuperación de antiguas variedades prefiloxéricas que, por distintos motivos, habían quedado relegadas y en algunos casos a punto de extinguirse. Gran parte de estas variedades son absolutamente minoritarias, solamente en entornos locales muy concretos y algunas de ellas ni siquiera se conocen. Probablemente algunas de ellas tengan un gran potencial enológico o un elevado poder de adaptación a diferentes zonas climáticas distintas a las que son originarias (Santiago et al., 2005; Gago et al., 2009; Martínez-Pinilla et al., 2013; Pérez-Magariño et al., 2013; Zinelabidine et al., 2014; Martínez et al., 2018; Gutiérrez-Gamboa and Moreno-Simunovic, 2019; Gutiérrez-Gamboa et al., 2020; Fernández-Pastor et al., 2023). Entre el desconocimiento que existe sobre sus características, destaca la falta de datos sobre sus niveles de resistencia a enfermedades fúngicas y más concretamente a mildiu. Desde un punto de vista práctico, el estudio de estas variedades permitirá el uso de algunas de ellas a nivel comercial, contribuyendo así a diversificar la oferta de vinos ligados a distintos territorios. A nivel científico el conocimiento de estos genotipos también es especialmente importante, ya que algunos de ellos podrían ser utilizados como material base para futuros programas de mejora, con el objetivo de obtener nuevas variedades resistentes a esta y a otras enfermedades (cruzamientos, transformación genética, etc.).
Este trabajo se ha llevado a cabo durante varias campañas y ha sido realizado por el grupo VIOR (Viticultura, Olivo y Rosa) de la Misión Biológica de Galicia-CSIC (MBG-CSIC), cuya investigadora responsable lidera el subproyecto “Valorización de variedades minoritarias de vid por su potencial para la diversificación vitivinícola. Resiliencia a enfermedades fúngicas influenciadas por el cambio climático” (MINORVIN) (RTI 2018-101085-RC32)”.
Uno de los objetivos de este subproyecto era evaluar la sensibilidad a mildiu de 63 variedades de vid españolas pre-filoxéricas minoritarias, cuyas muestras proceden de diferentes comunidades autónomas.
Material y métodos
Material vegetal
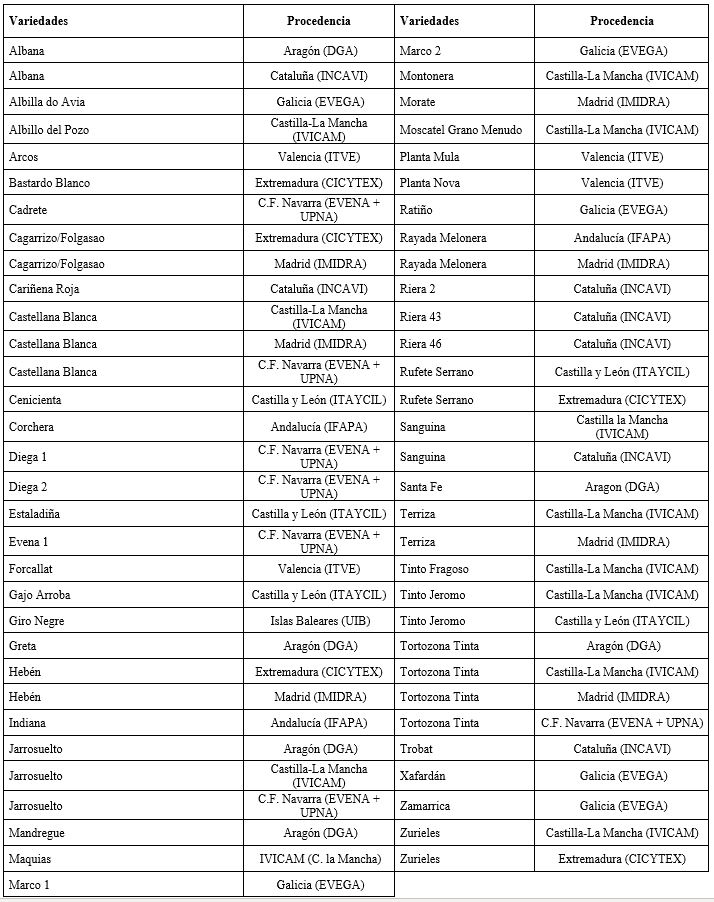
En el mes de enero-febrero, los diferentes grupos de investigación de cada entidad, enviaron a la MBG-CSIC, estaquillas perfectamente etiquetadas y embolsadas (Tabla 1).
Se procedió en primer lugar a su desinfección y parafinado, y fueron conservadas durante cuatro meses en cámara fría, con el objetivo de favorecer el posterior enraizamiento. Transcurrido ese tiempo, se realizaron dos tandas de enraizamiento/brotación de estaquillas para poder disponer de material vegetal suficiente con el que realizar las inoculaciones dirigidas. Una vez enraizadas y ya en macetas, las plantas se pasaron a invernadero bajo condiciones controladas de luz, temperatura y humedad. Se utilizaron como testigo los portainjertos 110- Ritcher altamente resistente (cruce entre V. berlandieri cv. Rességuier n°2 y V. rupestris cv. Martin) y SO4 tolerante (cruce entre V. berlandieri y V. riparia; selección Oppenheim de Teléki n°4). Se realizaron dos inoculaciones, la primera en el mes de junio y la segunda en julio.
Recolección y conservación del inóculo de Plasmopara vitivola
El inóculo se obtuvo a partir de las infecciones naturales que tuvieron lugar en el viñedo de la MBG-CSIC, siguiendo la metodología utilizada por Rumbolz et al. (2002).
Metodología para las inoculaciones dirigidas
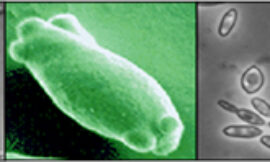
Se utilizó la Técnica del disco de la hoja propuesta por Staudt et al. (1995) y por Rumbolz et al. (2002) (Figura 1). Una vez que los brotes alcanzaron un tamaño suficiente para realizar las inoculaciones (15-30 cm), se seleccionaron 5 hojas (procedentes de los nudos 5º o 6º, contando desde el ápice del pámpano) de cada una de las variedades objeto de estudio y de la variedad testigo. Dichas hojas se desinfectaron, y de entre 5 seleccionadas por cada genotipo, se cortaron 30 discos que se colocaron en una misma placa de Petri. Cada uno de los discos se inoculó con P. viticola (50 mL de suspensión de esporangios y concentración 50.000 esporangios mL-1). El período de incubación fue de seis días, con una temperatura de 25 ºC, humedad relativa del 95 %, 16 horas de luz blanca y 8 horas de oscuridad. Al 5º día se observaron y evaluaron los síntomas de la infección, midiendo la incidencia de esporulación (porcentaje de discos con esporulación) así como la severidad de esporulación (superficie del disco ocupada por la esporulación) y densidad de esporulación (concentración de esporangios en el disco). Estos dos últimos parámetros se cuantificaron mediante una escala visual (0-25%: baja severidad y densidad; 25-50%: severidad y densidad media; 50-75%: alta severidad y densidad; 75-100%: muy alta severidad y densidad).

Los datos obtenidos para cada uno de estos parámetros, se sometieron a análisis de varianza (ANOVA) para comprobar si existían diferencias significativas entre las variedades estudiadas. Todos los parámetros que en el análisis de varianza mostraron una F significativa, se sometieron posteriormente a una comparación de medias, mediante la prueba de la Mínima Diferencia Significativa (MDS) protegida de Fisher. Los análisis estadísticos se realizaron con el paquete estadístico SAS System v8.1 (SAS, 2000).
Resultados y discusión
Se observaron diferencias significativas del 99,9 % entre las variedades, para los tres parámetros estudiados. De las 63 estudiadas, un 87 % mostraron elevada susceptibilidad, un 11% susceptibilidad intermedia y solamente un 2% susceptibilidad baja (Figura 2). Si analizamos cada parámetro evaluado separadamente se observa que, con respecto a la incidencia, un 87,5% de las variedades presentaron una incidencia superior al 75%; un 10,93% de las variedades una incidencia entre el 50-75% y solamente la variedad Morate, procedente del IMIDRA, presentó una incidencia inferior al 50% (concretamente un 34%). Con respecto a la severidad, la variedad Hebén, procedente de Extremadura, presentó la severidad más elevada (75%), un 29,68% de las variedades presentaron una severidad entre el 50-75%, un 14,6% severidad entre el 50-25% y solo cuatro variedades mostraron una susceptibilidad menor del 15% (Tinto Jeromo del IVICAM; Mandregue de Aragón-DGA; Marco 1 de Galicia- EVEGA y Planta Mula de Valencia-ITVE). Con respecto a la densidad de esporulación, 7 variedades presentaron una densidad superior al 75%; el 67,18% de variedades una densidad comprendida entre el 50% y el 75%, y el 21,87% de variedades, una densidad comprendida entre el 50% y 25%.
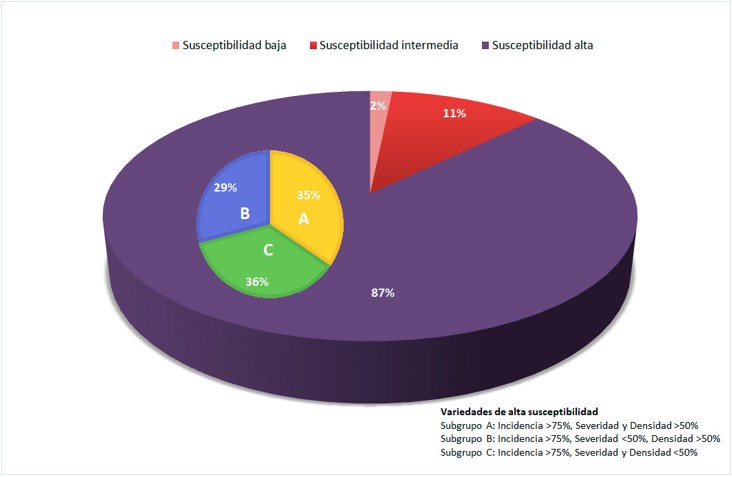
En general, la variedad Morate (Madrid, IMIDRA) fue la menos susceptible, con la incidencia, severidad y densidad de esporulación más bajas (<40%). Un grupo de variedades formado por Sanguina (Castilla-La Mancha, Ivicam), Planta Mula (Valencia, ITVE), Rayada Melonera (Madrid, IMIDRA), Zamarrica (Galicia, EVEGA), Cariñena Roja (Cataluña, INCAVI), Mandregue (Aragón, DGA) y Bastardo Blanco (Extremadura, CICYTEX), destacaron por presentar una susceptibilidad intermedia con una incidencia menor del 75%, severidad menor del 30% y densidad de esporulación menor del 50% (Figura 3). El resto de las variedades estudiadas, presentaron una elevada susceptibilidad.
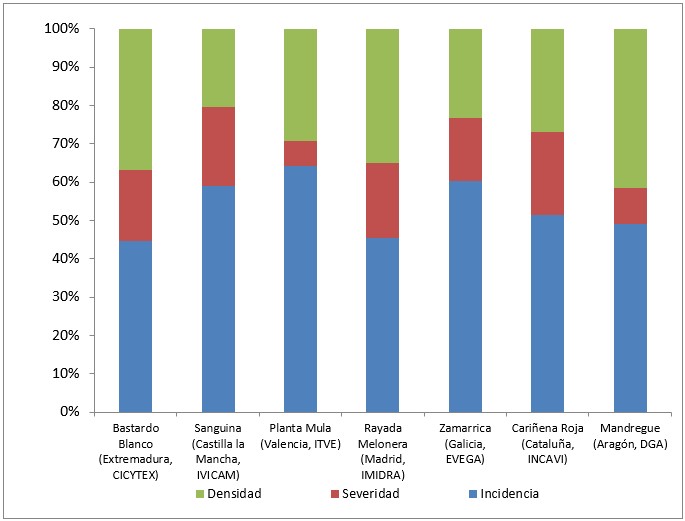
Estos resultados confirman una vez más la susceptibilidad a mildiu de todas las variedades pertenecientes a la especie V. vinífera, así como los diferentes grados de susceptibilidad que puede haber entre ellas. Por otro lado, mientras que el parámetro incidencia presenta un bajo poder para diferenciar la susceptibilidad a mildiu entre las distintas viníferas, la severidad y la densidad de esporulación se muestran como parámetros con alto poder discriminante, en este aspecto. Resultados similares fueron observados por Hernández et al. (2021) para oídio, con algunas de las variedades incluidas en este estudio.
Los datos obtenidos muestran también algunos casos de variedades que, dependiendo de la procedencia del ejemplar objeto de estudio, presentan diferentes grados de susceptibilidad (incidencia o densidad de esporulación). Así, por ejemplo, los ejemplares de la variedad Rayada Melonera procedentes del IFAPA (Andalucía) presentaron una mayor susceptibilidad (incidencia, severidad y densidad de esporulación) que los procedentes del IMIDRA (Madrid). Lo mismo ocurre con la variedad Hebén, cuyos ejemplares procedentes de CICYTEX (Extremadura) se mostraron más susceptibles que los procedentes del IMIDRA (Madrid). Otro caso es el de Castellana Blanca, donde los ejemplares procedentes de IVICAM (Castilla-La Mancha) presentaron una mayor incidencia que los procedentes del IMIDRA (Madrid) o de EVENA (Navarra). Para esta misma variedad, la densidad de esporulación de los ejemplares procedentes de EVENA (Navarra), se diferenciaron significativamente de los de las otras dos procedencias incluidas en el estudio (IVICAM-Castilla-La Mancha e IMIDRA- Madrid), que mostraron una mayor densidad de esporulación. Trabajos de otros autores (Gaforio et al., 2011), encuentran comportamientos similares con otras variedades como Chasselas Doré o Doña Blanca que, dependiendo del lugar del que proceden los ejemplares estudiados, muestran resistencia media o baja a mildiu u oídio. Este comportamiento, quizá debido a factores como las diferencias clonales, o las diferencias edafológicas, climáticas, o incluso de manejo del cultivo entre los distintos lugares de procedencia de las estaquillas utilizadas en el estudio, deberá ser analizado con mayor profundidad en el futuro, ya que puede darnos alguna clave para potenciar los mecanismos de defensa de las plantas frente a la infección por parte de algunos patógenos.
Otra cuestión a resaltar es que la mayor o menor susceptibilidad de las variedades estudiadas es independiente del color de sus bayas (blancas, negras o rosadas). A priori se podría pensar que las variedades tintas, debido a que presentan una mayor cantidad de ciertos compuestos fenólicos como el resveratrol (Frankel et al. 1995; Goldberg et al. 1995), iban a tener una menor susceptibilidad a mildiu (Dai et al. 1995; Pezet et al. 2004), tal y como apuntaban algunos autores (Langkcake and Pryce 1976; Montero et al. 2003), para otras enfermedades fúngicas como Botrytis cinerea, sin embargo, en este trabajo se ha visto que no existe tal correlación. Este resultado coincide con el observado por Boso et al. (2011) en diferentes viníferas evaluadas en campo.
La importancia práctica de este trabajo radica en que se han podido identificar algunas viníferas menos sensibles a mildiu, y por lo tanto necesitarían menor número de tratamientos fitosanitarios, lo que llevaría a reducir los costes de producción y a aumentar la sostenibilidad ambiental del cultivo. También es de destacar el hecho de que se trata de variedades minoritarias, poco o nada conocidas y utilizadas, cuya recuperación ayudaría a diversificar la oferta de vinos y a situar a España en una mejor posición frente a los mercados vitivinícolas internacionales. Desde el punto de vista científico, este material vegetal es de gran utilidad para profundizar en el estudio de los mecanismos de defensa de las viníferas frente a los ataques de distintos patógenos, e incluso para incluir algunas de ellas en programas de mejora para la obtención de nuevas variedades.
Agradecimientos
Proyecto Valorización de variedades minoritarias de vid por su potencial para la diversificación vitivinícola y de resiliencia al cambio climático (MINORVIN), RTI2018-101085-R-C31, 32 y 33 (subproyecto RTI 2018-101085-RC32 “Valorización de variedades minoritarias de vid por su potencial para la diversificación vitivinícola. Resiliencia a enfermedades fúngicas influenciadas por el cambio climático”) financiado por MCIN/AEI/10.13039/501100011033 y por FEDER – Una manera de hacer Europa. Han participado como técnicos de apoyo especializados, Elena Zubiaurre y Jorge Silva.

Bibliografia
. Boso, S., Alonso-Villaverde, V., Gago, P., Santiago, J., Martínez, M.: “Susceptibility of 44 grapevine (Vitis vinifera L.) varieties to downy mildew in the field. Australian Journal of Grape and Wine Research, 2011, 17(3):394-400.
. Boso, S., Alonso-Villaverde, V., Gago, P., Santiago, J.L., Martínez, M.C.: “Susceptibility to downy mildew (Plasmopara viticola) of different Vitis varieties. Crop Prot. 2014, 63: 26–35. doi:10.1016/j.cropro.2014.04.018
. Dai, GH., Andary C, Mondolot-Cosson, L., Boubals, D.: “Histochemical studies on the interaction between three species of grapevine, Vitis vinifera, V. rupestris and V. rotundifolia and the Downy mildew fungus, Plasmopara viticola”. Physiol Mol Plant P., 1995, 46: 177-188.
. Fernández-Pasto, M., Raboso, E., Espinosa, E., Muñoz-Organero, G., grupo Minorvin: “Variedades minoritarias como herramienta de adaptación del viñedo español al cambio climático. Acenologia, febrero 2018. https://www.acenologia.com/ratio_isotopico_carbono_cor0218/.
. Gaforio, L., García-Muñoz, S., Cabello, F., Muñoz-Organero, G.: “Evaluation of susceptibility to powdery mildew (Erysiphe necator) in Vitis vinifera varieties”. Vitis, 2011, 50 (3): 123-126.
Gago, P., Santiago, J.L., Boso, S., Alonso-Villaverde, V., Grando, S., Martínez, M.C.: “Biodiversity and Characterization of Twenty-two Vitis vinifera L. Cultivars in the Northwestern Iberian Peninsula”. American Journal of Enology and Viticulture, 2009, 60 (3): 293-301.
. Goldberg, DM., Yan-J, E-Ng., Diamandis, EP., Karumanchiri, A., Soleas, G., Waterhouse, ALA. : “Global survey of transresveratrol concentration in commercial wines”. Am J Enol Vitic. 1995, 46 (2): 159-165.
. Gutiérrez-Gamboa, G., Moreno-Simunovic, Y.: “Terroir and typicity of Carignan from Maule Valley (Chile): the resurgence of a minority variety”. Oeno One, 2019, 53:75–93.
. Gutiérrez-Gamboa, G.; Shu-Yan, L.; Pszczólkowski, P.: “Resurgence of minority and autochthonous grapevine varieties in South America: a review of their oenological potential”. J Sci Food Agric, 2020, 100: 465–482.
. Hernández, M.M., Castillo, C., Menéndez, C.M.:” Variability of Spanish minority varieties to Erysiphe necator infection”. 11th International Symposium on Grapevine Physiology and Biotechnology (31 October to 5 November 2021), South Africa.
. Lacombe, T. : « Contribution à l’étude de l’histoire évolutive de la vigne cultivée (Vitis vinifera L.) par l’analyse de la diversité génétique neutre et de gènes d’intérêt, Montpellier, France, 2012.
. Langcake, P., Pryce, R. J.: “The production of resveratrol by Vitis vinifera and other members of the Vitaceae as a response to infection or injury. Physiol Plant Pathol, 1976, 9: 77-86.
. Martínez, M.C., Boso, S., Gago, P., Muñoz-Organero, G., De Andrés, MT., Gaforio, L., Cabello, F., Santiago, J.L.: “Value of two Spanish live grapevine collections in the resolution of synonyms, homonyms and naming errors”. Australian Journal of Grape and Wine Research, 2018, 24, 430–438.
. Martínez-Pinilla, O., Guadalupe, Z., Ayestarán, B., Pérez-Magariño, S., Ortega-Heras, M.: “Characterization of volatile compounds and olfactory profile of red minority varietal wines from La Rioja”. J Sci Food Agric 2013, 93:3720–3729.
. Montero, C., Cristescu, S. M., Jiménez, J. B., Orea, J. M., Lintel Hekkert, S. T., Harren, F. J. M., González, U. A.: “Trans-resveratrol and grape resistance. A dynamic study by high-resolution laser-based techniques”. Plant Physiology, 2003, 131: 129–138.
. Pérez-Magariño, S., Ortega-Heras, M., Martínez-Lapuente, L., Guadalupe, Z., Ayestarán, B.: “Multivariate analysis for the differentiation of sparkling wines elaborated from autochthonous Spanish grape varieties: volatile compounds, amino acids and biogenic amines”. Eur Food ResTechnol, 2013, 236: 827–841.
. Pezet, R., Gindro, K., Viret, O., Spring, JL.: “Glycosylation and oxidative dimerization of resveratrol are respectively associated to sensitivity and resistance of grapevine cultivars to downy mildew”. Physiol Mol Plant P, 2004, 65: 297–303.
. Rumboulz, J., Wirtz, S., Kassemeyer, H. H., Buche, C.: “Sporulation of Plasmopara viticola: Differentiation and Light Regulation”. Plant Biology, 2002, 4 (3): 413-422.
. Santiago, J.L., Boso, S., Martínez, M.C., Pinto-Carnide, O., Ortiz, J.M.: “Ampelographic comparison of grape cultivars (Vitis vinifera L.) grown in northwestern Spain and northern Portugal”. American Journal of Enology and Viticulture, 2005, 56 (3): 287-290.
. SAS Institute Inc.: “SAS OnlineDoc, version 8. SAS institute, Inc., Cary”, North Carolina, U.S.A., 2000.
. Staudt, G. y Kassemeyer, H. H.: “Evaluation of downy mildew resistance in various accessions of wild Vitis species”. Vitis, 1995, 34 (4): 225-228.
. Zinelabidine, L.H.; Laiadi, Z.; Benmehaia, R.; Gago, P.; Boso, S.; Santiago, J.L.; Haddioui, A.; Ibáñez, J.; Martínez-Zapater, J.M.; Martínez, M.C.: “Comparative ampelographic and genetic analyses of grapevine cultivars from Algeria and Morocco”. Australian Journal of Grape and Wine Research, 2014, 20: 324–333.