El sector vitivinícola español se enfrenta actualmente a los desafíos del cambio climático y de la sostenibilidad medioambiental que pueden afectar a la producción de las variedades tradicionales. A estos factores hay que añadir el aumento en la presión de las enfermedades como consecuencia de la intensificación del cultivo y del endurecimiento de las restricciones en el uso de fitosanitarios contra los patógenos por las exigencias medioambientales y de residuos de la legislación europea. Hay que destacar que la vid es el cultivo de la UE que mayor número de tratamientos fitosanitarios recibe (Eurostat). Además, el vino es el alimento procesado que presenta la mayor frecuencia (3%) de múltiples residuos de pesticidas en muestras alimentarias (Cabrera y Pastor, 2022).
El sector vitivinícola español se enfrenta actualmente a los desafíos del cambio climático y de la sostenibilidad medioambiental que pueden afectar a la producción de las variedades tradicionales. A estos factores hay que añadir el aumento en la presión de las enfermedades como consecuencia de la intensificación del cultivo y del endurecimiento de las restricciones en el uso de fitosanitarios contra los patógenos por las exigencias medioambientales y de residuos de la legislación europea. Hay que destacar que la vid es el cultivo de la UE que mayor número de tratamientos fitosanitarios recibe (Eurostat). Además, el vino es el alimento procesado que presenta la mayor frecuencia (3%) de múltiples residuos de pesticidas en muestras alimentarias (Cabrera y Pastor, 2022).
El oídio, causado por el hongo Erysiphe necator, es una de las enfermedades más dañinas en la viticultura mundial y especialmente relevante en ambientes mediterráneos donde encuentra condiciones ideales de temperatura y humedad para la germinación de las esporas. El control de la enfermedad se realiza tradicionalmente mediante el uso de fungicidas desde la floración hasta el envero, práctica que genera problemas medioambientales y de salud a los consumidores. El hongo es un ascomiceto biótrofo, específico de las Vitaceas, que alterna ciclos de reproducción asexual y sexual, siendo esta última la responsable de su diversidad genética. La aparición de resistencias a varias materias activas presentes en fungicidas sistémicos genera ya serios problemas de manejo en algunas regiones vitícolas. Por otra parte, la predicción de los expertos en cambio climático sobre un incremento de la incidencia del oídio en los viñedos obliga a explorar nuevas estrategias más sostenibles de manejo de esta enfermedad.
En la interacción oídio-viña se han descrito 14 genes R de resistencia en diversas especies de Vitis originarias de Norteamérica, China y Asia Central (Vezulli et al., 2022). Los mecanismos de defensa codificados por estos genes abarcan desde la inmunidad y resistencia total, que puede incluir respuesta hipersensible en la planta, a diversos niveles de restricción del crecimiento del micelio y la esporulación del hongo. Varias accesiones de Vitis vinifera de Asia Central contienen también genes R. El gen Ren1 fue el primero identificado en dos variedades de uva de mesa “Kishmish vatkana” y “Dzhandzal kara” (Hoffmann et al., 2008) y en otras seis V. vinifera, así como en accesiones de V. vinifera sylvestris (Riaz et al., 2020).
Aunque no se han identificado genes de resistencia al oídio en variedades de vinificación, se reconocen diferencias en el grado de desarrollo de la enfermedad (Staudt G., 1997). Variedades como Chasselas, y Muscat se han caracterizado como menos susceptibles a la enfermedad (Demirel Asci et al., 2021, Pavlousek, 2007).
El viñedo es un sistema de cultivo con un alto riesgo de pérdida de biodiversidad por la globalización en el uso de unas pocas variedades, como indica Anna Puig-Pujol en el artículo introductorio a este monográfico. Así, en los 15 países con mayor superficie vitícola a nivel mundial, menos de 10 variedades ocupan más del 60% de la superficie cultivada. Este hecho unido al alto consumo de fitosanitarios apunta a la necesidad de mejorar la resiliencia del sistema vitícola frente a enfermedades. Explotar la riqueza del patrimonio vitícola potenciando las variedades minoritarias es una alternativa interesante en el actual contexto de cambio climático que permitirá, además, diversificar la producción de vino. En este sentido, es necesario caracterizar la respuesta de estas variedades frente a enfermedades fúngicas que dependen tanto en su inicio como en su distribución geográfica de las condiciones del clima.
El objetivo principal de esta investigación ha sido ampliar el conocimiento de la enorme diversidad varietal española para seguir manteniendo y mejorar la calidad de producción de los vinos, permitiendo encontrar variedades con una mayor tolerancia a la infección por Erysiphe necator. Estas nuevas variedades contribuirán a un desarrollo más sostenible de este cultivo en el escenario actual de cambio climático.
Los resultados de este estudio se centran en el análisis de la respuesta de las variedades minoritarias al hongo causante del oídio en la vid. Para ello, se han realizado ensayos in vitro inoculando hojas jóvenes en ensayos replicados en dos años consecutivos con controles resistentes y susceptibles (Kishmish vatkana y Mazuelo, respectivamente). Las inoculaciones se llevaron a cabo con una torre de inoculación al vacío, que proporciona una infección masiva y una difusión uniforme de las esporas. El grado de crecimiento y reproducción del hongo a los 7 y 14 días después de la inoculación (dpi) se determinó con una escala del 1 al 5, siendo el 1 la que indica menor crecimiento (0) y la 5 el mayor (> 90 % de la superficie de la hoja cubierta por conidios). Los datos se proporcionan también transformados en índices de severidad (0-1) para una mayor estandarización.
Estos ensayos, realizados durante los años 2020 y 2021, han sido liderados por investigadoras del Instituto de Ciencias de la Vid y Vino (ICVV), dentro del proyecto nacional “Valorización de variedades minoritarias de vid por su potencial para la diversificación vitivinícola y de resiliencia al cambio climático (MINORVIN)”. Se han estudiado un total de 54 variedades minoritarias (24 blancas y 30 tintas), procedentes de todo el territorio nacional, 11 de ellas procedían de más de una zona. Para un estudio preliminar se han agrupado en base a su procedencia en: Andalucía (And), Aragón (Ara), Cataluña (Cat), Castilla-La Mancha (CLM), Castilla y León (CyL), Extremadura (Ext), Galicia (Gal), Islas Baleares (IB), Madrid (Mad), Navarra (Nav), País Vasco (PV) y Comunidad Valenciana (Val).
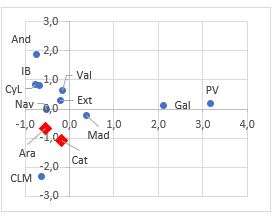
En primer lugar se realizó un análisis de componentes principales usando el valor medio de los índices de severidad de las variedades en cada zona, con el fin de determinar la similitud entre zonas en la respuesta al hongo. En la Figura 1 se muestran todas las comunidades de procedencia en el espacio bidimensional. Las variedades de Galicia y País Vasco se presentan muy distanciadas del resto, en la parte positiva de la primera dimensión, caracterizándose éstas por la alta incidencia de la enfermedad a los 14 dpi. En el caso del País Vasco no hubo representación suficiente, ya que solo se ensayó una variedad. Las variedades de Aragón y Cataluña quedaron muy próximas, situadas en la parte negativa de la segunda dimensión, junto con las de Castilla-La Mancha. La variable que primordialmente definió este espacio fue el desarrollo del hongo a los 7 dpi. En estas dos zonas, también se encontraron algunas de las más tolerantes. Por ello, en este trabajo se han analizado en detalle las variedades procedentes de Aragón y Cataluña.
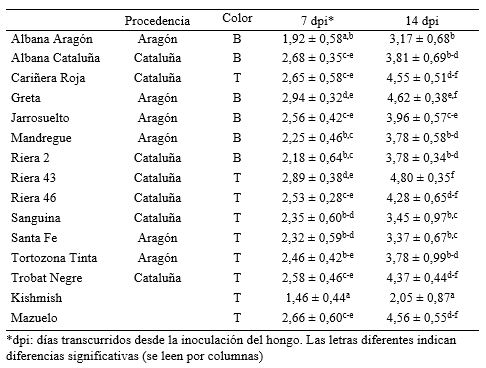
En el análisis de comparación de medias entre las variedades (ANOVA, p < 0,05) se encontraron diferencias significativas en la respuesta a la infección (Tabla 1). Albana de Aragón resultó ser una de las más interesantes por dar la respuesta más cercana a la variedad Kishmish, usada como referencia por ser portadora del gen Ren 1 (Hoffman et al., 2008). Estas variedades se suman a otras minoritarias como las italianas Alphonse Lavallée y Ohanez (Miazzi et al., 2010), o las españolas Maturana y Turruntés (Hernández et al., 2009) por su mayor resistencia al ataque del hongo. En el otro extremo de la distribución se encuentra Riera 43 de Cataluña, tan susceptible como Mazuelo. A pesar de la alta susceptibilidad de la especie V. vinifera al oídio, y que la mayoría de las variedades, en especial las comerciales, presentan índices de severidad relativamente altos, la existencia de recursos genéticos que presentan una mayor resiliencia a la enfermedad les dota de un valor adicional que puede impulsar su utilización.
La variedad Albana fue la única coincidente en Aragón y Cataluña. Esta variedad presentó pequeñas diferencias en la respuesta, excepto en el segundo año en el que la procedente de Cataluña mostró una alta incidencia de la enfermedad a los 14 días (Figura 2). La mayor uniformidad en la respuesta a la infección puede estar asociada a una menor variabilidad intravarietal en Aragón o a la respuesta diferencial a la diversidad en las poblaciones fúngicas en los dos años.
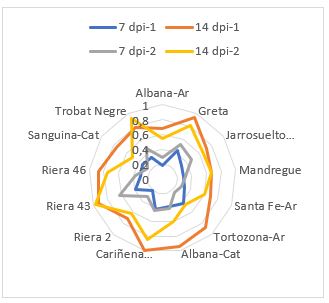
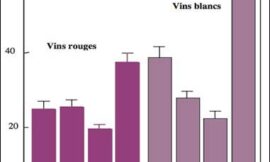
Las posibles interacciones entre los factores año, color y procedencia se estudiaron mediante un análisis multivariante. El color fue el factor con mayor significación, dado que a los 7 dpi las variedades blancas presentaron un desarrollo del hongo más avanzado. Estas diferencias se diluyeron con el tiempo, e incluso a los 14 dpi las tintas alcanzaron valores de incidencia superiores a las blancas. Esta respuesta puede deberse a un mecanismo de defensa estructural más robusto en las variedades tintas que dificulta la entrada del patógeno. En esta defensa, los metabolitos secundarios, en especial los compuestos fenólicos, juegan un importante papel (Dixon et al., 2002; Martín et al., 2019; Schnee et al., 2008 y Taware et al., 2010).
Con el fin de agrupar las variedades por sus semejanzas en la respuesta a los 7 y 14 dpi en los 2 años de estudio, se hizo un análisis jerárquico que rindió 4 grupos (Figura 3). Los dos primeros grupos englobaron las variedades con mayor resistencia al patógeno: Albana, Mandregue, Santa Fe y Tortozona de Aragón; y Riera 2 y Sanguina de Cataluña. El grupo 4, por el contrario, incluyó las variedades con mayor desarrollo del hongo, donde se sitúan las catalanas Trobat Negre, Riera 43 y Cariñena Roja, y la variedad Greta de Aragón.
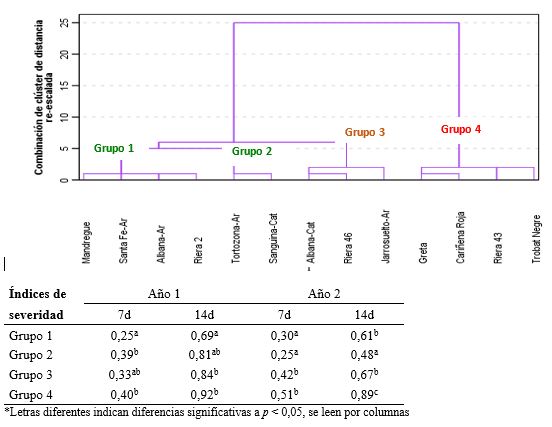
Este trabajo aporta conocimiento sobre el comportamiento de las variedades frente al oídio, valorizando las variedades Albana, Santa Fe y Mandregue de Aragón y Riera 2 de Cataluña que han mostrado buenas características agronómicas, una maduración media y/o tardía y buenos rendimientos, y vinos con media – baja acidez (Fernández-Pastor et al., 2023). Además, proporciona materiales de interés para estudios metabolómicos y genómicos que den respuesta a las diferencias fenotípicas observadas y suministren herramientas para mejorar el manejo de las enfermedades de forma más sostenible.
Agradecimientos
Proyecto Valorización de variedades minoritarias de vid por su potencial para la diversificación vitivinícola y de resiliencia al cambio climático (MINORVIN), RTI2018-101085-R-C31, 32 y 33 financiado por MCIN/AEI/10.13039/501100011033 y por FEDER – Una manera de hacer Europa.

Bibliografía
. Carrasco Cabrera L y Medina Pastor P.: “The 2020 European Union report on pesticide residues in food”. EFSA Journal 2022;20 (3): 7215, 57 pp. https://doi.org/10.2903/j.efsa.2022.7215
. Demirel Aşçi, S., Tangolar, S., Kazan, K., (…), Tangolar, S., Ergül, A.: “Evaluation of powdery mildew resistance of a diverse set of grape cultivars and testing the association between powdery mildew resistance and pr gene expression”. Turkish J. Agr. Forestry, 2021, 45 (3): 273-284. https://doi.org/10.3906/tar-2009-109
. Dixon, R.A., Achnine, L., Kota, P., Liu, C.J., Reddy, M.S.S. y Wang, L.: “The phenylpropanoid pathway and plant defence – A genomics perspective”. Molecular Plant Pathol. 2002, 3 (5): 371–390. https://doi.org/10.1046/j.1364-3703.2002.00131.x
. Eurostat. The use of plant protection products in the European Union. https://ec.europa.es/Eurostat/web/products-statistical-books/-IKS-7606669
. Fernández-Pastor, M., Raboso, E., Espinosa, F.E., Muñoz-Organero, G., y Grupo MINORVIN: “Variedades minoritarias como herramienta de adaptación del viñedo español al cambio climático”. Acenología, febrero, 2023. https://www.acenologia.com/variedades_minoritarias_como_herramienta_de_adaptacion_del_vinedo_espanol_al_cambio_climatico/
. Hernández, M.M., Pérez-Moreno, I., Martínez de Toda, F., Menéndez, C.M.: “Assessment of the variability for tolerance to powdery mildew in grapevine germplasm from La Rioja”. Acta Horticulturae, 2009, 827: 571-574.
. Hoffmann, S., Di Gaspero, G., Kovács, L., Howard, S., Kiss, E., Galbács, Z., Testolin, R., Kozma, P.: “Resistance to Erysiphe necator in the grapevine “Kishmish vatkana” is controlled by a single locus through restriction of hyphal growth”. Theor. App. Gen. 2008, 116 (3): 427–438. https://doi.org/10.1007/s00122-007-0680-4
. Martín, L., Fontaine, F., Castaño, F.J., Songy, A., Roda, R., Vallet, J., Ferrer-Gallego, R.: “Specific profile of Tempranillo grapevines related to Esca-leaf symptoms and climate conditions”. Plant Physiol. Biochem. 2019, 135: 575–587. https://doi.org/10.1016/j.plaphy.2018.10.040
. Miazzi, M.; Hajjeh, H., Faretra, F.: “An in vitro method to evaluate grapevine cultivars for Erysiphe necator susceptibility”. In Vitro Cell. Dev. Biol. Plant 2010, 46: 363-367.
. Pavloušek, P.: “Evaluation of resistance to powdery mildew in grapevine genetic resources”. J. Central Eu. Agr., 2007, 8 (1): 105-113.
. Riaz S., Menéndez, C.M., Pap D., Tenscher. A.M., Walker M.A.: “Genetic mapping and survey of powdery mildew resistance in the wild Central Asian ancestor of cultivated grapevines”. Hort Res. 2020, 7:104. https://doi.org/10.1038/s41438-020-0335-z
. Schnee, S., Viret, O., Gindro, K.: “Role of stilbenes in the resistance of grapevine to powdery mildew”. Physiol. Mol. Plant Pathol. 2008, 72, 128–133. https://doi.org/10.1016/j.pmpp.2008.07.002
. Staudt G.: “Evaluation of resistance to grapevine powdery mildew (Uncinula necator [Scuw.] Burr., anamorph Oidium tuckeri Berk.) in accessions of Vitis species”. Vitis, 1997, 36(3): 151-154.
. Taware, P.B., Dhumal, K.N., Oulkar, D.P., Patil, S.H., Banerjee, K.: “Phenolic alterations in grape leaves, berries and wines due to foliar and cluster powdery mildew infections”. Internal. J. Pharma Bio Sci. 2010, 1 (1).
. Vezulli, S., Gramaje, D., Tello, J., …Reisch, B.: Genomic designing for biotic stress resistant grapevine. 2022. Springer. https://doi.org/10.1007/978-3-030-91802-6_4