El estudio de los procesos microbianos involucrados en la elaboración de vino, al margen de la bien conocida fermentación alcohólica, ha dado lugar a una extensa línea de investigación con las levaduras llamadas no Saccharomyces como centro de interés. El conocimiento sobre el potencial enzimático de las levaduras no Saccharomyces constituye un pilar fundamental que sustenta su interés en Enología para la mejora de las propiedades tecnológicas y sensoriales de los vinos elaborados en la industria.
Incremento del carácter varietal de los vinos
Enzimas glicosidasas para la liberación de aromas terpénicos
La importancia de los terpenos en el carácter varietal de ciertas variedades de uva blanca es bien conocido, siendo los descriptores principales de variedades como moscatel, riesling o alvariño (Marais, 1983), aunque recientemente ha sido considerada su presencia y relevancia en ciertas variedades de uva tinta. La composición en terpenos libres en los mostos es escasa, sin embargo, existe en estas variedades una cantidad notable de terpenos conjugados con azúcares en forma de compuestos glicosilados (Maicas y Mateo, 2005). Estos terpenos glicosilados pueden ser liberados por hidrólisis enzimática por acción de enzimas glicosidasas (Mateo y Di Stefano, 1998).
La revelación de compuestos aromáticos de tipo terpénico a partir de sus precursores glicosilados en la uva fue uno de los primeros abordajes en la investigación enológica de levaduras no Saccharomyces (Vasserot et al., 1989). La escasa actividad β-glucosidasa en condiciones enológicas de la inmensa mayoría de cepas de S. cerevisiae, necesaria para completar el proceso de liberación de aromas terpénicos glicosilados, ha conducido a la búsqueda de especies de levadura alternativas para una revelación más efectiva de estos aromas varietales.
La liberación de los compuestos terpénicos requiere de la actuación secuencial en dos pasos de dos enzimas hidrolíticas. El primer paso consiste en la actuación de una enzima β-xilosidasa, α-L-arabinofuranosidasa, α-ramnosidasa o β-apiosidasa según el azúcar que se encuentre unido al complejo terminal glucosa-terpeno (fig. 1).
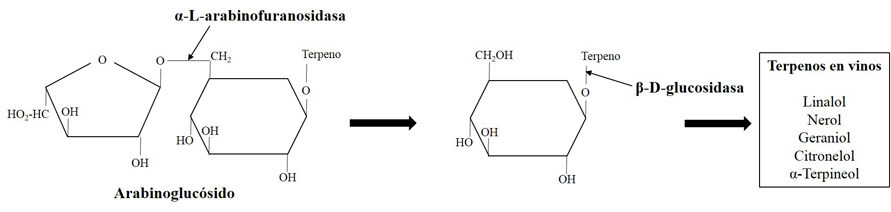
El segundo paso, determinante para la liberación del aroma terpénico, es siempre llevado a cabo por β-glucosidasas. Aunque algunas cepas de S. cerevisiae son productoras de actividades glicolíticas como β-xilosidasa, apenas existen cepas con actividad β-glucosidasa (Ubeda-Iranzo et al., 1998; Van Rensburg et al., 2005), existiendo, en cualquier caso, una fuerte represión catabólica por la presencia de glucosa en el medio, lo que limita su utilidad a las etapas finales de la fermentación (Aryan et al., 1987, Gunata et al., 1993). Esta ausencia de actividades en S. cerevisiae conduce a la búsqueda de levaduras no Saccharomyces con estas actividades y, preferiblemente, con una menor represión por glucosa.
Así, son varios los estudios que han desarrollado procesos de selección de levaduras en base a estas actividades (Vasserot et al., 1989; Rosi et al., 1994; McMahon et al., 1999; Manzanares et al., 1999; Fernández et al., 2003; Mateo et al., 2011). Mendes-Ferreira et al. (2001) identificaron Kloeckera apiculata, Wickerhamomyces anomalus y Metschnikowia pulcherrima como potenciales candidatos para su uso en la liberación de terpenos por mostrar una intensa actividad β-glucosidasa.
«Son pocos los trabajos científicos que reporten, a una escala industrial, el aumento de la complejidad en aromas terpénicos en los vinos por no Saccharomyces, por lo que su consecución supone un reto actual para la investigación enológica.»
Para que el potencial enzimático de estas especies pueda llegar a ser aplicado en la revelación aromática en vinos, las cepas que las presenten han de cumplir ciertos requisitos referentes a la alta afinidad sobre los derivados terpénicos glicosilados en la uva, una actividad óptima al pH del mosto, cierta resistencia a la represión por glucosa y una alta tolerancia al etanol. A este respecto cabe destacar los trabajos de Cordero-Otero et al., (2003) en los que pudieron identificar una cepa de Debaryomyces pseudopolymorphus que, además de mostrar alta actividad β-glucosidasa, previamente identificada en D. hansenii (Maicas y Mateo, 2005), presentó alta tolerancia a la presencia de glucosa y etanol en el medio generando un incremento notable de geraniol y citronelol en los vinos fermentados con esta especie de levadura.
Estudios realizados en nuestro grupo de investigación sugieren que la actividad β-D-xilosidasa, además de en S. cerevisiae, se encuentra ampliamente distribuida en la mayoría de especies de levaduras aisladas en ambientes enológicos. Por el contrario, la actividad α-L-arabinofuranosidasa se muestra como la más restrictiva en cuanto a su distribución entre las levaduras no Saccharomyces más habituales en enología, destacando la actividad de especies como W. anomalus o M. guilliermondii, utilizadas hasta el momento con poco éxito en fermentaciones industriales.
En la actualidad son pocos o casi inexistentes los trabajos científicos que reporten, a una escala industrial, el aumento de la complejidad en aromas terpénicos en los vinos por no Saccharomyces, por lo que su consecución supone un reto actual para la investigación enológica.
β-liasas en enología para la liberación de aromas tiólicos
Las β-liasas, denominadas en enzimología cistationin-β-liasas o L-cistationina L-homocisteínα-liasas (CE 4.4.1.8), son enzimas que catalizan reacciones de eliminación beta de conjugados de cisteína que poseen un grupo aceptor de electrones unido en el azufre. Los productos finales de la reacción de las β-liasas son piruvato, amonio y un fragmento que contiene azufre (Cooper y Pinto 2005, 2006; Cooper et al., 2010.; Holt et al., 2012).
En la naturaleza existen una gran variedad de sustratos S-conjugados a cisteína que son sustratos de enzimas β-liasas, muchos de ellos se encuentran en alimentos como el ajo y la cebolla, generando su olor característico. En las uvas y mostos existen una serie de aromas ligados a precursores S-conjugados a cisteína, son los denominados aromas varietales tiólicos. Estos, como consecuencia de la actividad β-liasa de las levaduras, pueden producir aromas deseables en el vino cuyos descriptores principales son el aroma a pomelo, frutas tropicales y boj, característicos de vinos de variedades como verdejo o sauvignon blanc (Swiegers et al., 2007; Roncoroni et al., 2011).
Los tioles varietales principales, y mejor descritos en vinos blancos, son 4-mercapto-4-metilpentan-2-ona (4MMP), 3-mercaptohexanol (3MH) y su derivado acetilado, 3- mercaptohexil acetato (3MHA) obtenido por acción de una alcohol acetiltransferasa, que se encuentran en la uva en forma de precursores no odorantes conjugados a cisteína y son liberados durante la fermentación alcohólica mediante la actividad β-liasa que presentan las levaduras (fig. 2).
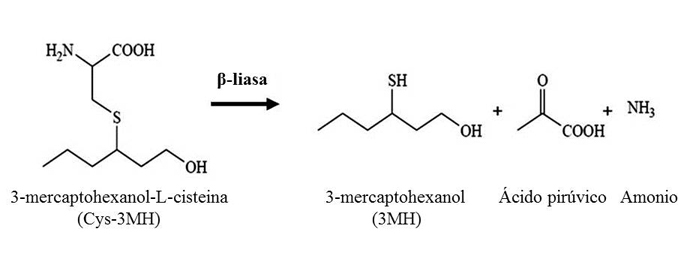
Los estudios realizados en mayor profundidad sobre esta actividad han sido realizados en S. cerevisiae, observándose la presencia de cepas con mayor o menor actividad β-liasa y, por tanto, con mayor o menor potencialidad a la hora de revelar aromas varietales tiólicos. Por esta razón, es muy ventajoso seleccionar y emplear aquellas levaduras con una elevada expresión de actividad β-liasa para obtener la máxima expresión del potencial aromático tiólico del mosto (Howell et al., 2004; Howell et al., 2005.). Son distintos genes (BNA3, CYS3, GLO1, IRC7, STR3) los que han sido descritos como implicados en la liberación de aromas tiólicos en S. cerevisiae (Thibon et al., 2008), pero IRC7 y STR3 parecen ser los responsables directos de la liberación de dichos aromas en base a la codificación de enzimas β-liasas (Roncoroni et al., 2011). El enzima β-liasa codificado por IRC7 parece ser el más activo de todos ellos estando directamente relacionado con la liberación de 4MMP.
Se acepta de manera casi general que la conversión de los precursores cisteinilados en sus correspondientes aromas tiólicos es muy limitada durante la elaboración de vino, típicamente inferior al 10%, por lo que se pone de manifiesto que las cepas de S. cerevisiae más eficaces no son capaces de completar la transformación de una parte significativa de los precursores de aroma unidos a cisteína. Además, se ha descrito que la actividad β-liasa está regulada negativamente mediante un mecanismo denominado represión catabólica por nitrógeno, por lo que en presencia de nutrientes nitrogenados la levadura libera en menor medida dichos aromas (Swiegers y Pretorius 2007; Harch y Gardner 2013).
No se han realizado estudios específicamente dirigidos a estudiar el potencial revelador de aromas tiólicos en diversas especies no Saccharomyces, y por tanto, los datos disponibles en la actualidad, a menudo empíricos, tan solo corresponden a los obtenidos al observar las propiedades enológicas de ciertas levaduras no Saccharomyces comercializadas por distintas casas comerciales. Por ejemplo, la levadura Torulaspora delbrueckii NS-TD comercializada por Agrovin, S.A. y cuya fisiología en fermentación ha sido recientemente descrita (Belda et al., 2015a), muestra una elevada actividad β-liasa, incluso superior a la mostrada por cepas de S. cerevisiae descritas como muy recomendadas para potenciar estos aromas tiólicos en vinos blancos.
Mejora de propiedades tecnológicas de los vinos
Enzimas pectinasas en enología
Los enzimas pectinolíticos presentan un gran interés en la mejora de ciertos aspectos tecnológicos y sensoriales en la elaboración de vino, influyendo en el proceso de clarificación y en la filtrabilidad de mostos y vinos, así como en la liberación de compuestos aromáticos y de color presentes en la uva (Fernández-González et al., 2005). Esta liberación es posible gracias a su actuación hidrolítica sobre los polisacáridos pécticos que constituyen la pared de las células vegetales (fig. 3). Tradicionalmente, los complejos enzimáticos de origen fúngico con actividad pectinolítica son aplicados tanto en etapas prefermentativas como postfermentativas (Kashyap et al., 2001) por su contribución en la mejora de procesos de clarificación, extracción durante la maceración o la filtrabilidad de los vinos. Estos preparados enzimáticos contienen en general una mezcla de actividades pectín liasa, pectín metilesterasa y poligalacturonasa (Lang y Dornenburg, 2000). De estos, dos tipos de poligalacturonasa, endo y exopoligalacturonasa, son los principales responsables de la actividad pectinolítica en vinos y, por ello, dichas actividades han recibido mayor interés por parte de científicos e industria (Torres et al., 2006).
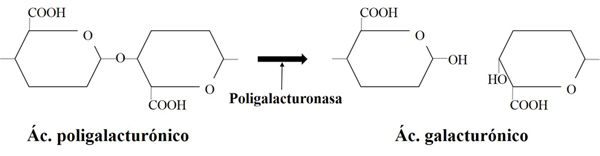
La adición de estos preparados enzimáticos fúngicos constituye un coste significativo para las bodegas, por lo que la búsqueda de levaduras capaces de producirlas constituye un objetivo interesante. Sin embargo, se ha descrito que al menos un 75% de las cepas enológicas de S. cerevisiae presentan una actividad pectinolítica muy limitada. En este contexto se han desarrollado un gran número de cepas recombinantes de S. cerevisiae con actividades pectinasas heterólogas más eficientes mediante ingeniería genética del gen PGU1 de S. cerevisiae (Blanco et al., 1998; Gognies et al., 1999, 2001; Jia y Wheals, 2000; Vilanova et al., 2000; Gainvors et al., 2000; Blanco et al., 2002; Fernández-González et al., 2004, 2005). Sin embargo, la falta de aceptación de organismos genéticamente modificados en la industria enológica obliga a la búsqueda de levaduras naturales como fuente alternativa de enzimas pectinolíticos (Charoenchai et al., 1997; Strauss et al., 2001).
Resultados recientes confirman la efectividad del uso de levaduras no Saccharomyces para la mejora de parámetros como la extracción de polifenoles, antocianos y otros pigmentos, o la contribución a la mejora de la turbidez y filtrabilidad de los vinos (Belda et al., 2015b). Los resultados, en vías de publicación, obtenidos en nuestro grupo de investigación confirman que la actividad poligalacturonasa de M. pulcherrima es efectiva para la mejora de los citados parámetros en la elaboración de vinos tintos tanto a escala de laboratorio como a escala industrial. Estos resultados, además, confirman la influencia de la temperatura en la efectividad de dichos enzimas, siendo favorable las temperaturas bajas para la actuación de los enzimas pectinolíticos, aumentando el tiempo de contacto de los hollejos que permite una mayor hidrólisis de las paredes celulares.
Los resultados sugieren que, además de estas razones estrictamente químicas, los procesos de maceración fría contribuyen a la extracción de color por el mayor desarrollo de levaduras no Saccharomyces con actividades pectinolíticas. De un total de 16 especies de levaduras analizadas, aisladas de ambientes enológicos, tan solo Aureobasidium pullulans, M. pulcherrima y M. fructicola mostraron actividad poligalacturonasa. Otros estudios han descrito la presencia de dicha actividad en cepas de Meyerozyma guilliermondii y D. hansenii pero de orígenes no enológicos (Sanchez et al., 1984) y en un número muy limitado de cepas de las especies Candida stellata, C. oleophila, C. valida y K. apiculata, pero no describiendo un comportamiento característico de especie (Strauss et al., 2001).
Enzimas proteolíticos para la prevención de la quiebra proteica
Los problemas de inestabilidad o quiebra proteica en los vinos blancos constituyen un inconveniente en la calidad de los vinos en lo que respecta a su percepción visual. La aparición de la quiebra proteica puede solucionarse mediante la eliminación de las proteínas de la uva que siguen presentes tras el proceso de fermentación (Sluyter et al., 2015).
Las proteínas responsables de la aparición de la turbidez característica de la quiebra proteica son, en general, relacionadas con ciertas patologías de la uva, altamente estables durante la elaboración del vino, pero que terminan por precipitar con el paso del tiempo. La eliminación de proteínas se logra actualmente mediante la adición de bentonita, un proceso no del todo eficiente que implica un coste considerable para las bodegas no ausente de inconvenientes sensoriales para el vino.
El uso de enzimas proteasas para la degradación de estas proteínas se postula como una alternativa al uso de la bentonita con menor incidencia sobre la calidad final de los vinos. Su adición durante el proceso de fermentación puede contribuir en cierto grado a la liberación de péptidos y aminoácidos fácilmente metabolizables por las levaduras como fuente de nitrógeno, contribuyendo a mejorar los desequilibrios nutricionales del mosto y disminuir la necesaria adición de nutrientes, mejorando el perfil sensorial de los vinos (Guitart et al., 1999; Pretorius et al., 2000). La adición de enzimas proteolíticas en la industria es frecuente en procesos como la elaboración de cerveza, en la que el uso de papaína, una cistein-proteasa procedente de la papaya, ha sido probado, constituyendo una opción viable en su uso en la elaboración de vino (Rehmanji et al., 2005).
A este respecto y, partiendo de la ausencia de actividad proteasa en la inmensa mayoría de cepas de S. cerevisiae, cabe destacar el potencial de W. anomalus como levadura productora de enzimas proteolíticas, siendo también notable el potencial de cepas de M. pulcherrima o K. marxianus, ambas descritas como poseedoras de características metabólicas óptimas para un aumento de la calidad del vino en su uso combinado con S. cerevisiae. Apenas existen experiencias sobre el uso de levaduras como fuente de enzimas proteolíticos para el control de la inestabilidad proteica en vinos. Los estudios llevados a cabo por Dizy y Bisson (2000) indican la ausencia de una efectividad significativa en el uso de levaduras no Saccharomyces para la degradación proteica, por lo que es necesario continuar profundizando en el estudio de esta actividad enzimática para su aplicación enológica y cuya optimización puede constituir un nuevo pilar que sustente el uso de levaduras no Saccharomyces en bodega.
Bibliografía
Aryan AP, Wilson B, Strauss CR, Williams PJ (1987) The properties of glycosidases of Vitis vinifera and comparison of their β-glucosidase activity with that of exogenous enzymes. An assessment of possible applications in enology. Am J Enol Vitic 38: 182-8.
Belda I, Navascués E, Marquina D, Santos A, Calderón F, Benito S (2015a) Dynamic analysis of physiological properties of Torulaspora delbrueckii in wine fermentations and its incidence on wine quality. Appl Microbiol Biotechnol 99: 1911-1922.
Belda I, Conchillo LB, Ruiz J, Navascués E, Alonso A, Marquina D, Santos A (2015b) Rational selection of yeasts based on their pectinolytic activities and its incidence on technological and sensorial aspects of wine quality. VI European Congress of Microbiology-FEMS (Maastricht): pp. 2420.
Blanco P, Sieiro C, Diaz A, Villa TG (1994) Production of an endopolygalacturonase from Saccharomyces cerevisiae. Can J Microbiol 40: 974-977.
Blanco P, Thow G, Simpson CG, Villa TG, Williamson B (2002) Mutagenesis of key amino acids alters activity of a Saccharomyces cerevisiae endo-polygalacturonase expressed in Pichia pastoris. FEMS Microbiol Lett 210: 187-191.
Charoenchai C, Fleet GH, Henschke PA, Todd BEN (1997). Screening of non-Saccharomyces wine yeast for the presence of extracellular hydrolytic enzymes. Aust J Grape Wine Res 3:2-8.
Cooper AJ, Krasnikov BF, Pinto JT, Bruschi SA (2010). Measurement of cysteine S-conjugate β-lyase activity. Current Protocols in Toxicology. Chapter 4. 36:1-17.
Cooper AJ, Pinto JT (2005). Aminotransferase, L-amino acid oxidase and beta-lyase reactions involving L-cysteine S-conjugates found in allium extracts. Relevance to biological activity? Biochem Pharmacol 69: 209-220.
Cooper AJ, Pinto JT (2006). Cysteine S-conjugate beta-lyases. Amino Acids 30:1-15.
Cordero Otero R, Ubeda JF, Briones-Perez AI, Potgieter N, Villena MA, Pretorius IS, Van Rensburg P (2003) Characterization of the β-glucosidase activity produced by enological strains of non-Saccharomyces yeast. J Food Sci 68: 2564-2569.
Dizy M, Bisson LF (2000) Proteolytic activity of yeast strains during grape juice fermentation. Am J Enol Vitic 51:155−167.
Fernandez M, Di Stefano R, Briones A (2003) Hydrolysis and transformation of terpene glycosides from Muscat must by different yeast species. Food Microbiol 20:35-41.
Fernández-González M, Úbeda JF, Cordero-Otero RR, Thanvanthri-Gururajan V, Briones AI (2005) Engineering of an oenological Saccharomyces cerevisiae strain with pectinolytic activity and its effect on wine. Int J Food Microbiol 102:173-183.
Fernández-González M, Úbeda JF, Vasudevan TG, Cordero-Otero RR, Briones AI (2004) Evaluation of polygalacturonase activity in Saccharomyces cerevisiae wine strains. FEMS Microbiol Lett 237:261-266.
Gainvors A, Nedjaoum N, Gognies S, Muzart M, Nedjma M, Belarbi A (2000). Purification and characterization of acidic endo-polygalacturonase encoded by the PGL1-1 gene from Saccharomyces cerevisiae. FEMS Microbiol Lett 183:131-135.
Gognies S, Gainvors A, Aigle M, Belarbi A (1999) Cloning, sequence analysis and overexpression of a Saccharomyces cerevisiae endopolygalacturonase-encoding gene (PGL1). Yeast 15:11-22.
Gognies S, Simon G, Belarbi A (2001) Regulation of the expression of endopolygalacturonase gene PGU1 in Saccharomyces. Yeast 18:423- 432.
Guitart A, Orte PH, Ferreira V, Peña C, Cacho J (1999) Some observations about the correlation between the amino acid content of musts and wines of the Chardonnay variety and their fermentation aromas. Am J Enol Vitic 50, 253−258.
Gunata Z, Dugelay I, Sapis JC, Baumes R, Bayonove C (1993) Role of the enzymes in the use of the flavour potential from grape glycosides in winemaking. In: Schreier P, Winterhalter P (eds) Progress in flavour precursor studies. Alured, Carol Stream, pp 219-234
Harsch MJ, Gardner RC (2013) Yeast genes involved in sulfur and nitrogen metabolism affect the production of volatile thiols from Sauvignon Blanc musts. Appl Microbiol Biotechnol 97:223-235.
Holt S, Cordente AG, Curtin C (2012) Saccharomyces cerevisiae STR3 and yeast cystathionine β-lyase enzymes: The potential for engineering increased flavor release. Bioengineered bugs 3: 178-80.
Howell KS, Klein M, Swiegers JH, Hayasaka Y, Elsey GM, Fleet GH, Høj PB, Pretorius IS, de Barros Lopes MA (2005). Genetic determinants of volatile-thiol release by Saccharomyces cerevisiae during wine fermentation. Appl Environ Microbiol 71: 5420-5426.
Howell KS, Swiegers JH, Elsey GM, Siebert TE, Bartowsky EJ, Fleet GH, Pretorius IS (2004). Variation in 4-mercapto-4-methyl-pentan-2-one release by Saccharomyces cerevisiae commercial wine strains. FEMS Microbiol Lett 240: 125-129.
Jia J, Wheals AE (2000) Endopolygalacturonase genes and enzymes from Kluyveromyces marxianus and Saccharomyces cerevisiae. Curr Genet 38: 264- 270.
Kashyap DR, Vohra PK, Chopra S, Tewari R (2001) Applications of pectinases in the commercial sector: a review. Bioresource Technol 77: 215-227.
Lang C, Dornenburg H (2000) Perspectives in the biological function and the technological application of polygalacturonases. Appl Microbiol Biotechnol 53: 366-375.
Maicas S, Mateo JJ (2005) Hydrolysis of terpenyl glycosides in grape juice and other fruit juices: a review. Appl Microbiol Biotechnol 67: 322-35.
Manzanares P, Ramon D, Querol A (1999) Screening of non- Saccharomyces wine yeasts for the production of β-D-xylosidase activity. Int J Food Microbiol 46: 105-112.
Marais J (1983) Terpenes in the aroma of grapes and wines: a review. S Afr J Enol Vitic 4:49-60.
Mateo JJ, Di Stefano R. 1998. Enological properties of β-glucosidase in wine yeasts. Food Microbiol 14: 583-591.
Mateo JJ, Peris L, Ibañez C, Maicas S (2011) Characterization of glycolytic activities from non-Saccharomyces yeasts isolated from Bobal musts. J Ind Microbiol Biotechnol 38:347-354.
McMahon H, Zoecklein BW, Fugelsang K, Jasinski Y (1999) Quantification of glycosidase activities in selected yeasts and lactic acid bacteria. J Ind Microbiol Biotechnol 23:198-203.
Mendes-Ferreira A, Clımaco MC, Mendes-Faia A (2001) The role of non-Saccharomyces species in releasing glycosidic bound fraction of grape aroma components-a preliminary study. J Appl Microbiol 91: 67-71.
Pretorius IS (2000) Tailoring wine yeast for the new millennium: novel approaches to the ancient art of winemaking. Yeast 16:675−729.
Rehmanji M, Gopal C, Mola A (2005) Beer stabilization technology − clearly a matter of choice. Master Brew Assoc Am Technol Q 42: 332−338.
Roncoroni M, Santiago M, Hooks DO, Moroney S, Harsch MJ, Lee SA, Richards KD, Nicolau L, Gardner RC (2011) The yeast IRC7 gene encodes a ß-lyase responsible for production of the varietal thiol 4-mercapto-4-methylpentan-2-one in wine. Food Microbiol 28: 926-935.
Rosi I, Vinella M, Domizio P (1994) Characterization of β-glucosidase activity in yeasts of enological origin. J Appl Bacteriol 77: 519-527.
Sanchez J, Guiraud JP, Galzy P (1984) A study of the polygalacturonase activity of several yeast strains isolated from cocoa. Appl Microbiol Biotechnol 20: 262-267.
Strauss MLA, Jolly NP, Lambrechts .G, van Rensburg P (2001) Screening for the production of extracellular hydrolytic enzymes by non-Saccharomyces wine yeasts. J Appl Microbiol 91: 182-190.
Swiegers JH, Pretorius IS (2007) Modulation of volatile sulfur compounds by wine yeast. Appl Microbiol Biotechnol 74: 954-960.
Thibon, C., et al. 2008. Nitrogen catabolic repression controls the release of volatile thiols by Saccharomyces cerevisiae during wine fermentation. FEMS Yeast Res 8: 1076-1086.
Torres EF, Sepulveda TV, Gonzalez GV (2006) Production of hydrolytic depolymerising pectinases. Food Technol Biotechnol 44: 221-227.
Ubeda-Iranzo JF, Briones-Perez AI, Izquierdo-Cañas PM (1998) Study of the oenological characteristics and enzymatic activities of wine yeasts. Food Microbiol 15: 399-406.
Van Rensburg P, Stidwell T, Lambrechts MG, Cordero-Otero RR, Pretorius IS (2005) Development and assessment of a recombinant Saccharomyces cerevisiae wine yeast producing two aroma-enhancing β-glucosidases encoded by the Saccharomycopsis fibuligera BGL1 and BGL2 genes. Anal Microbiol 55: 33-42.
Van Sluyter SC, McRae JM, Falconer RJ, Smith PA, Bacic A, Waters EJ, Marangon M (2015) Wine Protein Haze: Mechanisms of Formation and Advances in Prevention. J Agric Food Chem 63:4020-4030.
Vasserot Y, Christiaens H, Chemardin P, Arnaud A, Galzy P (1989) Purification and properties of a b-glucosidase of Hanseniaspora vineae Van der Walt and Tscheuschner with the view to its utilization in fruit aroma liberation. J Appl Bacteriol 66: 271-279.
Vilanova M, Blanco P, Cortes S, Castro M, Villa TG, Sieiro C (2000) Use of a PGU1 recombinant Saccharomyces cerevisiae strain in oenological fermentations. J Appl Microbiol 89: 876-883.






